
【题目】酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂,用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2===K2SO4+2MnSO4+5O2↑+8H2O,当有6 mol H2SO4参加反应,有________mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为__________________________
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色,溶液先变为浅绿色的离子方程式是_______________ ,再变为棕黄色的原因是_______________
【答案】10 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ 酸性条件下NO3-将Fe2+氧化成Fe3+
【解析】
(1)用双线桥分析反应,根据物质的量之间的关系计算。
(2)酸性条件下MnO4-被还原成Mn2+,H2C2O4被氧化成CO2,根据得失电子守恒、原子守恒、电荷守恒配平书写离子方程式。
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色;溶液先变为浅绿色,因为SO32-具有还原性,SO32-将Fe3+还原为Fe2+,自身被氧化为SO42-;再变为棕黄色,说明酸性条件下NO3-将Fe2+氧化成Fe3+;据此分析作答。
(1)用双线桥分析反应为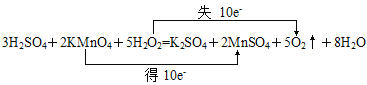 ,反应中H2O2为还原剂,每3molH2SO4参与反应将有5molH2O2被氧化,则6molH2SO4参与反应有10molH2O2被氧化。
,反应中H2O2为还原剂,每3molH2SO4参与反应将有5molH2O2被氧化,则6molH2SO4参与反应有10molH2O2被氧化。
(2)酸性条件下MnO4-被还原成Mn2+,H2C2O4被氧化成CO2,反应可写成MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O,1mol MnO4-反应得到5mol电子,1mol H2C2O4反应失去2mol电子,根据得失电子守恒配平为2MnO4-+5H2C2O4+H+→2Mn2++10CO2↑+H2O,结合原子守恒、电荷守恒,离子方程式为2MnO4-+5H2C2O4+6H+=Mn2++10CO2↑+8H2O。
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色;溶液先变为浅绿色,因为SO32-具有还原性,SO32-将Fe3+还原为Fe2+,自身被氧化为SO42-,反应的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;再变为棕黄色,说明酸性条件下NO3-将Fe2+氧化成Fe3+,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。


科目:高中化学 来源: 题型:
【题目】如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是
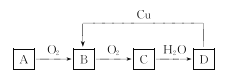
A. 氯 B. 铁 C. 碳 D. 氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法错误的是
物质 | 杂质 | 除杂剂 | |
A | 镁粉 | 铝粉 | 过量烧碱溶液 |
B | FeCl3(溶液) | FeCl2 | 氯气 |
C | CO2 | HCl | 饱和Na2CO3溶液 |
D | Cl2 | HCl | 饱和食盐水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带除供食用外,大量用于制碘。提取碘的途径如下所示,正确的是
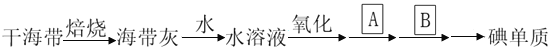
A. 碘元素在海水中也有游离态存在
B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶
D. B是提纯操作,常用蒸馏或分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国卫生组织经过考察和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广,其主要原因是( )
A.价格便宜,不易生锈B.有银白色金属光泽,导电性好
C.烹调的食物中留有人体需要的铁元素D.传热慢,保温性能好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
A.MnO2与浓盐酸共热B.Al与NaOH溶液
C.食盐和浓硫酸共热D.铜片和浓硫酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物电池可进行多种污水净化和海水淡化的综合处理,该电池装置的示意图如图所示,其中污
水中的有机物用C6H10O5表示,海水用食盐水代替。下列说法正确的是

A. b膜为阴离子交换膜
B. 处理后的含NO3-污水的pH降低
C. 负极反应式为C6H10O5+7H2O+24e-==6CO2↑+24H+
D. 导线中流过lmol电子,理论上有1molCl-通过a膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com