
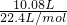 =0.45mol;
=0.45mol;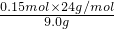 ×100%=0.4,
×100%=0.4,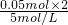 =0.02L=20ml;生成最大量测定需要氢氧化钠物质的量=0.15mol×2+0.2mol×3=0.9mol,消耗氢氧化钠溶液体积=
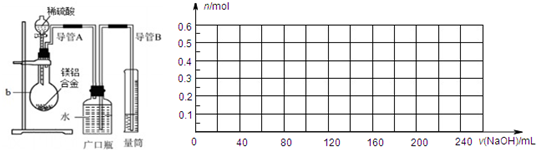
=0.02L=20ml;生成最大量测定需要氢氧化钠物质的量=0.15mol×2+0.2mol×3=0.9mol,消耗氢氧化钠溶液体积=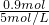 =0.18l=180ml;沉淀氢氧化铝全部溶解发生反应:Al(OH0)3+OH-=AlO2-+2H2O;需要氢氧化钠物质的量为0.2mol,体积为40ml;共消耗氢氧化钠溶液体积=20ml+180ml+40ml=240mol;依据沉淀最大量为0.35mol;氢氧化镁沉淀为0.15mol;结合图象画法,描点画出图象为
=0.18l=180ml;沉淀氢氧化铝全部溶解发生反应:Al(OH0)3+OH-=AlO2-+2H2O;需要氢氧化钠物质的量为0.2mol,体积为40ml;共消耗氢氧化钠溶液体积=20ml+180ml+40ml=240mol;依据沉淀最大量为0.35mol;氢氧化镁沉淀为0.15mol;结合图象画法,描点画出图象为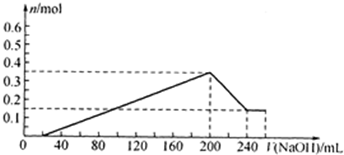 ,故答案为:
,故答案为: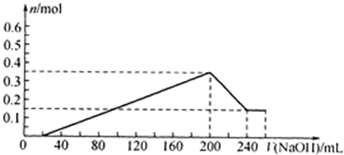 .
.

 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:阅读理解
| 氢氧化钠溶液 |
| 盐酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| NaOH溶液 |
| 盐酸 |

 问题讨论:
问题讨论:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
材料一:酸雨是英国化学家R.A.Smith 1872年最先提出的,一般是指pH小于5.6的雨、雪、雾等大气降水,是大气污染的表现。酸雨被称作“空中死神”。据某市区1998年环境状况公报载,市区酸雨频率为41.3%,比上年上升了5.5个百分点。降水的年平均pH为4.87,降水酸性污染较严重,表现为煤烟型污染特征。
材料二:①某地一场较大范围的酸雨使植物叶面遭到腐蚀,产生大量斑点而坏死,导致西瓜大面积绝产,损失惨重。②酸雨使植物阳离子从叶面析出,使钙、镁、铁等离子迅速从土壤中损失,土壤营养状况降低,还使光合作用受到抑制,影响植物的生长。③铝对生物来说是有害元素,在土壤中以氧化铝形式存在,pH=5.6时几乎不溶解。当pH为4.6时,铝的溶解度增加100倍,并转化成硫酸铝,造成树木死亡。四川某林场,华山松死亡率达96%,就是酸雨使土壤中硫酸铝浓度增高,危及华山松。
材料三:我国农业生产因遭受酸雨造成的损失每年高达15亿元。为了有效控制酸雨,国务院已经批准了《酸雨控制区和二氧化硫控制区划分方案》等规定。
某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水作水样进行测定,随时间的推移,多次测定该样品的pH,得到如下数据:
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)问题:①雨水样品放置时pH变化的主要原因(用化学方程式表示)_____________________;由此可以得出酸雨的形成过程可能是______________________________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将_________________ (填“增大”“减小”或“不变”),原因是__________________________________;二氧化硫表现_____________性。
(2)列举酸雨给人类造成的危害。
(3)你认为减少酸雨产生的途径可采取的下列措施是__________________________________。
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①③ B.②③④⑤ C.①③⑤ D.①③④⑤
(4)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用Ca(OH)2的悬浊液吸收煤燃烧时产生的二氧化硫气体,并回收制得有用的石膏(CaSO4·2H2O),则有关反应的化学方程式_____________________,__________________,___________________。
②硫酸工业常用浓氨水来吸收二氧化硫,则有关的化学方程式为_____________________。
③有些工业采取将生石灰和含硫煤混合使用。请写出燃烧时有关“固硫”反应的化学方程式。__________________________________________
④国际上最新采用“饱和亚硫酸钠溶液吸收SO2法”。请写出有关反应的化学方程式。_____________________
⑤请比较以上四种“固硫”方法的优缺点。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
[探究一]
实验方案:铝镁合金![]() 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是______________________。
实验步骤:(1)称取
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_________(填“偏高”或“偏低”)。
[探究二]
实验方案:铝镁合金![]() 测定生成气体的体积
测定生成气体的体积
实验装置:

问题讨论:(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是_____________。(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①_______________________________,②________________________________。
[探究三]
实验方案:称量x g铝镁合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:(1)欲计算Mg的质量分数,该实验中还需测定的数据是____________。
(2)若用空气代替O2进行实验,对测定结果是否有影响?___________(填“是”或“否”)。
[实验拓展]
参照探究一、探究二的实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
试根据下述材料完成问题:
材料一:酸雨是英国化学家R.A.Smith 1872年最先提出的,一般是指pH小于5.6的雨、雪、雾等大气降水,是大气污染的表现。酸雨被称作“空中死神”。据某市区1998年环境状况公报载,市区酸雨频率为41.3%,比上年上升了5.5个百分点。降水的年平均pH为4.87,降水酸性污染较严重,表现为煤烟型污染特征。
材料二:①某地一场较大范围的酸雨使植物叶面遭到腐蚀,产生大量斑点而坏死,导致西瓜大面积绝产,损失惨重。②酸雨使植物阳离子从叶面析出,使钙、镁、铁等离子迅速从土壤中损失,土壤营养状况降低,还使光合作用受到抑制,影响植物的生长。③铝对生物来说是有害元素,在土壤中以氧化铝形式存在,pH=5.6时几乎不溶解。当pH为4.6时,铝的溶解度增加100倍,并转化成硫酸铝,造成树木死亡。四川某林场,华山松死亡率达96%,就是酸雨使土壤中硫酸铝浓度增高,危及华山松。
材料三:我国农业生产因遭受酸雨造成的损失每年高达15亿元。为了有效控制酸雨,国务院已经批准了《酸雨控制区和二氧化硫控制区划分方案》等规定。
某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水作水样进行测定,随时间的推移,多次测定该样品的pH,得到如下数据:
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
问题:①雨水样品放置时pH变化的主要原因(用化学方程式表示)_____________________;由此可以得出酸雨的形成过程可能是
______________________________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将_________________ (填“增大”“减小”或“不变”),原因是__________________________________;二氧化硫表现_____________性。
(2)列举酸雨给人类造成的危害。
(3)你认为减少酸雨产生的途径可采取的下列措施是
__________________________________。
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①③ B.②③④⑤ C.①③⑤ D.①③④⑤
(4)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用Ca(OH)2的悬浊液吸收煤燃烧时产生的二氧化硫气体,并回收制得有用的石膏(CaSO4·2H2O),则有关反应的化学方程式_____________________,
__________________,___________________。
②硫酸工业常用浓氨水来吸收二氧化硫,则有关的化学方程式为_____________________。
③有些工业采取将生石灰和含硫煤混合使用。请写出燃烧时有关“固硫”反应的化学方程式。
④国际上最新采用“饱和亚硫酸钠溶液吸收SO2法”。请写出有关反应的化学方程式。
⑤请比较以上四种“固硫”方法的优缺点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com