
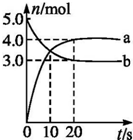
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
| △c |
| △t |
| △c |
| △t |
| ||
| 20s |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有共价键的化合物不一定是共价化合物 |
| B、在共价化合物中一定含有共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、离子键就是阴阳离子结合成化合物的静电引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
C、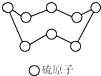 32g硫(结构见图)含S-S的数目为NA 32g硫(结构见图)含S-S的数目为NA |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管滴加 |
有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管, |
说明溶液A含有NH4+ | |
| 步骤3:往c试管逐滴加入 |
先产生 后 |
说明溶液A含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
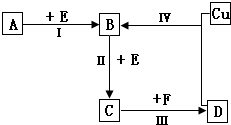 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、按照系统命名法, 的名称为3,3,4-三甲基己烷 的名称为3,3,4-三甲基己烷 |
| B、乙醇、乙酸和乙酸乙酯可以用饱和Na2CO3溶液鉴别 |
| C、苯乙烯中所有原子可能共平面 |
D、1.0mol的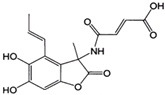 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com