
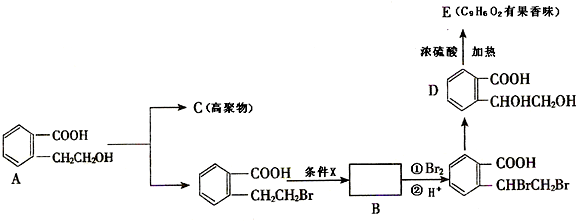
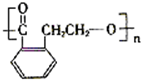
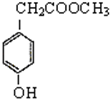
 ,A和HBr发生取代反应生成
,A和HBr发生取代反应生成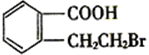 ,
,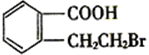 发生反应生成B,B和溴发生加成反应
发生反应生成B,B和溴发生加成反应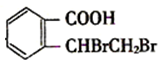 ,则
,则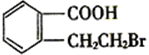 应该发生消去反应生成B,B的结构简式为
应该发生消去反应生成B,B的结构简式为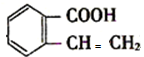 ,
,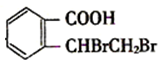 和NaOH的水溶液加热生成D,D在浓硫酸作催化剂、加热条件下发生酯化反应生成E,根据C原子个数知,D自身发生酯化反应,E中不饱和度=
和NaOH的水溶液加热生成D,D在浓硫酸作催化剂、加热条件下发生酯化反应生成E,根据C原子个数知,D自身发生酯化反应,E中不饱和度=| 9×2+2-6 |
| 2 |
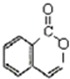 ,据此分析解答.
,据此分析解答. ,A和HBr发生取代反应生成
,A和HBr发生取代反应生成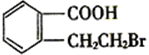 ,
,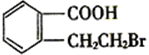 发生反应生成B,B和溴发生加成反应
发生反应生成B,B和溴发生加成反应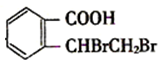 ,则
,则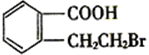 应该发生消去反应生成B,B的结构简式为
应该发生消去反应生成B,B的结构简式为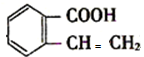 ,
,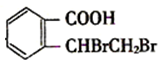 和NaOH的水溶液加热生成D,D在浓硫酸作催化剂、加热条件下发生酯化反应生成E,根据C原子个数知,D自身发生酯化反应,E中不饱和度=
和NaOH的水溶液加热生成D,D在浓硫酸作催化剂、加热条件下发生酯化反应生成E,根据C原子个数知,D自身发生酯化反应,E中不饱和度=| 9×2+2-6 |
| 2 |
 ,
,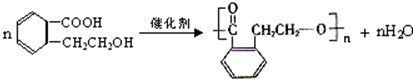 ,
, ;
;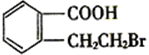 和NaOH的醇溶液、加热而发生消去反应生成B,B的结构简式为
和NaOH的醇溶液、加热而发生消去反应生成B,B的结构简式为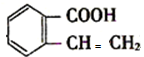 ,
,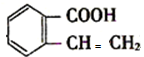 ;
; ,故答案为:
,故答案为: ;
; ,
, .
.


科目:高中化学 来源: 题型:
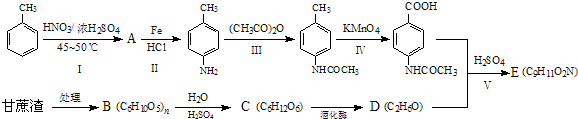
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| CH3C≡CNa |

| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
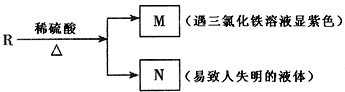
 三氯化铁是中学化学实验室中不可缺少的重要试剂.
三氯化铁是中学化学实验室中不可缺少的重要试剂.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
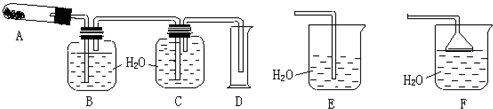
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、几种物质都有 |
| B、有甲酸乙酯和甲酸 |
| C、有甲酸乙酯和甲醇 |
| D、有甲酸乙酯,可能有甲醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com