
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
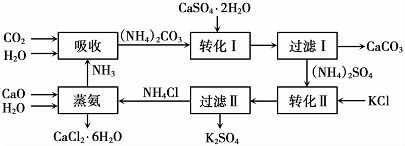
分析 (1)由流程图分析:吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3;
(2)根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤,得到碳酸钙与硫酸铵;CaSO4微溶且为悬浊液、CaCO3不溶,所以二者在离子方程式中均不拆,然后配平即可;
(3)过滤Ⅰ操作所得固体中,除CaCO3外还主要含有过量微溶的CaSO4;
(4)根据碳酸根离子与酸反应能生成二氧化碳,有气泡产生;
(5)根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算;
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关;
(7)根据绿色化学的特点进行分析.碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).
解答 解:(1)由流程图可知,吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2•6H2O和NH3.
故答案为:CaCO3(或CaO)、NH3、H2O;
(2)根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤得到碳酸钙与硫酸铵,CaSO4微溶且为悬浊液、CaCO3不溶,所以在离子方程式中均不拆;然后配平即可;故答案为:CaSO4+CO32-=CaCO3+SO42-;
(3)CaSO4微溶且为悬浊液,故过滤Ⅰ操作所得固体中,除CaCO3外还主要含有过量微溶的CaSO4;
故答案为:CaSO4;
(4)碳酸根离子与酸反应能生成二氧化碳,所以可以用稀盐酸来验证碳酸根离子,检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-;
故答案为:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-;
(5)根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算,(100+18.2):(18.2-7.4)=591:x,解得:x=54g;
故答案为:54;
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关,
故答案为:ad;
(7)由绿色化学的特点可知,碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中);
故答案为:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).
点评 本题为工艺流程题,涉及原料、产品的判断、方程式的书写、检验、绿色化学等.做推断题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测,难度较大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 吸热反应不加热不可能进行反应 | |
| D. | 反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ | |
| D. | FeSO4溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| 平均值 | |||||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
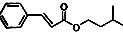 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: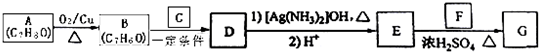
 ;
;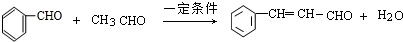 .
.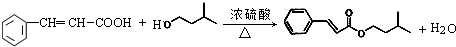 ,反应类型为酯化反应或取代反应.
,反应类型为酯化反应或取代反应.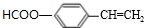 、
、 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3 | B. | Cu→CuSO4 | C. | Fe→FeCl2 | D. | Al→Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用金属钠或者金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com