
【题目】已知FeS溶于盐酸中,生成FeCl2和H2S气体。现将100mL2.0mol/L的盐酸加入到一定量的FeS固体中,以制备H2S气体。当盐酸完全反应后假定溶液体积不变。
试计算:(1)可收集到的H2S气体在标准状况下的体积___________________;
(2)反应后溶液中FeCl2的物质的量浓度_________________________。
【答案】2.24L 1mol/L
【解析】
FeS溶于盐酸中,生成FeCl2和H2S气体,发生反应的化学方程式为FeS + 2HCl = FeCl2 + H2S↑,结合原子守恒和浓度公式解题即可。
n(HCl) = c(HCl) ×V(溶液) = 2.0mol/L×0.1L=0.2mol,根据FeS + 2HCl = FeCl2 + H2S↑可知,生成的n(H2S) =0.1mol、n( FeCl2) = 0.1mol,则:
(1)可收集到的H2S气体在标准状况下的体积为0.1mol ×22.4L/mol=2.24L;
(2)反应后溶液中FeCl2的物质的量浓度c( FeCl2) =![]() = 1mol/L。
= 1mol/L。


科目:高中化学 来源: 题型:
【题目】I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
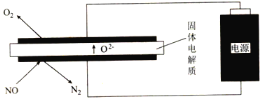
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A. ①②③B. ①③④C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成与开发大量自然界并不存在的新物质、新材料,并为人类服务是现代化学的重要任务。请结合所学知识回答下列问题:
(1)沙滩上沙粒的主要成分是____。工业上可用沙粒的主要成分与纯碱在高温下反应制备Na2SiO3,该反应的化学方程式为____。
(2)氯气溶于水能杀菌消毒,在新制氯水中滴入紫色石蕊试液的现象是___,该现象说明氯水中含有_______(填化学式或离子符号)。
(3)直接用氯气作漂白剂,难以保存,效果不理想。经过多年的实验、改进,目前常用的是漂白粉。工业制取漂白粉的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物之间可以相互转化,请按照要求回答下列问题:
(1)下列有关NO和NO2的描述正确的是__________(填标号)。
a.均为无色气体 b.均为大气污染物 c.可用排水集气法收集NO
(2)写出二氧化氮与水反应的化学方程式_______,其中被氧化的N与被还原的N的物质的量之比为__________。
(3)如下是生成NO2的几个化学反应:
①2NO+O2=2NO2 ②Fe+ 6HNO3(浓)= Fe (NO3)3 + 3NO2↑+3H2O ③4HNO3![]() O2↑+4NO2↑+2H2O ④N2O4
O2↑+4NO2↑+2H2O ④N2O4![]() 2NO2
2NO2
其中体现N元素还原性的是_____ (填标号,下同),体现N元素氧化性的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3![]() 5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
A. ②③B. ③④C. ①②D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
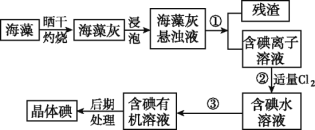
(1)实验室灼烧海藻,需要下列仪器中的____(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①_____________,③______。
(3)提取碘的过程中,可选择的有机试剂是_____。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)小组用CCl4萃取碘水中的碘,在分液漏斗中进行,下层液体呈____色;他们打开分液漏斗活塞,却未见液体流下,原因可能是____________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:

①________; ② _________; ③_________。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___________,最后晶态碘在____里聚集。
Ⅱ.海水开发利用可以提取NaCl和Mg(OH)2。
(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过溶解、________、_________等操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A. 将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀可知二者均可使人中毒
B. 可以用足量氢氧化钠溶液加热的方法区别地沟油(分离过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)
C. 市场销售的洗涤灵的主要成分是对十二烷基苯磺酸钠,它能洗去餐具上的油污,发生的主要是化学变化
D. 粮食酿酒的过程:淀粉![]() 葡萄糖
葡萄糖![]() 乙醇
乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在课堂上,老师演示了金属钠与![]() 溶液反应的实验,同学们观察到该反应中生成了蓝色的
溶液反应的实验,同学们观察到该反应中生成了蓝色的![]() 沉淀和气泡,而没有发现铜单质。某同学想,会不会是因为生成的铜较少而被蓝色沉淀所覆盖从而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
沉淀和气泡,而没有发现铜单质。某同学想,会不会是因为生成的铜较少而被蓝色沉淀所覆盖从而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
(1)假如你是该同学,请你写一份实验准备单交给老师,要求老师提供必需的用品。
①实验探究的目的:___________。
②探究所依据的化学原理:_____________。
③实验必需的仪器或用品:小刀、玻璃片、滤纸、漏斗、玻璃棒、铁架台、____和烧杯; 药品:金属钠、![]() 溶液和______。
溶液和______。
(2)该同学在探究实验中意外地发现了生成的蓝色沉淀中混有少量的黑色难溶物,而所使用的药品均没有问题,你认为该黑色难溶物是____________(填化学式),生成该黑色难溶物的原因是(结合化学方程式和必要的文字作答)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com