
| A. | Cu2+、Br-、HCO3-、AlO2- | B. | Fe3+、K+、SCN-、SO42- | ||
| C. | Fe2+、NO3-、HSO3-、Ag+ | D. | Na+、AlO2-、K+、C6H5O- |
分析 配制的溶液中的各离子之间不反应,能够大量共存,
A.铜离子与碳酸氢根离子、偏铝酸根离子发生双水解反应,碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸根离子;
B.铁离子与硫氰根离子反应生成硫氰化铁;
C.亚铁离子、银离子能够与亚硫酸氢根离子反应,亚硫酸根离子能够电离出氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子和亚硫酸氢根离子;
D.四种离子之间不发生反应,能够共存.
解答 解:溶液中存在的各离子之间应该不发生反应,可大量共存,
A.Cu2+与HCO3-、AlO2-发生双水解反应,碳酸氢根离子的酸性大于氢氧化铝,HCO3-、AlO2-反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故A错误;
B.Fe3+、SCN-之间反应生成氯化氢硫氰化铁,在溶液中不能大量共存,故B错误;
C.Fe2+、Ag+能够与HSO3-离子反应,HSO3-能够电离出氢离子,NO3-在酸性条件下能够氧化Fe2+、HSO3-,在溶液中不能大量共存,故C错误;
D.Na+、AlO2-、K+、C6H5O-之间不发生反应,能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 全部都可以 | B. | 全部都不可以 | C. | ②③④ | D. | 仅①可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制普通玻璃的原料主要是纯碱、石灰石和石英砂 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 普通玻璃的主要成分中有硅酸钠、硅酸钙 | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
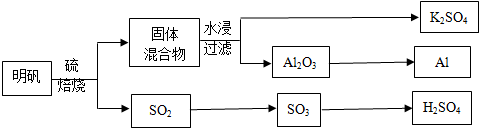

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
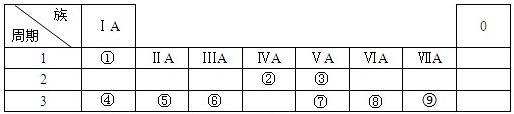
 ;元素的⑨离子结构示意图是
;元素的⑨离子结构示意图是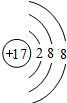 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com