
(13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
(13分)
(1)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (2)C(2分)
(3)Fe(OH)3+3HF=FeF3+3H2O(2分) (4)通风橱(或密闭容器)(2分)
(5)FeF3+3Li=Fe+3LiF(2分) (6)Fe4O5(或2FeO?Fe2O3)(3分)
解析试题分析:(1)H2O2把Fe2+氧化为Fe3+,在酸性条件下的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)步骤②加入了过量的氢氟酸溶液,玻璃和陶瓷中含有二氧化硅,而二氧化硅能与氢氟酸反应,所以A、B项错误,故C项正确。
(3)沉淀为Fe(OH)3,加入氢氟酸发生酸碱中和反应,化学方程式为:Fe(OH)3+3HF=FeF3+3H2O
(4)反应过程中,挥发出腐蚀性气体HF,所以从安全的角度考虑,在实验室里制三氟化铁时应在通风橱(或密闭容器)中进行。
(5)Li的活泼性大于Fe,所以三氟化铁与Li发生置换反应的化学方程式为:FeF3+3Li=Fe+3LiF
(6)Cl2的物质的量为0.672L÷22.4L/mol=0.03mol,Cl2氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为0.03mol×2=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为9.6g÷160g/mol=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,所以铁氧体样品含Fe2O3的物质的量为:0.03mol,所以该铁氧体的化学式为Fe4O5(或2FeO?Fe2O3)
考点:本题考查物质制备方案的分析、化学方程式和离子方程式的书写、混合物的计算。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
 2Fe2O3+4CO2
2Fe2O3+4CO2查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下: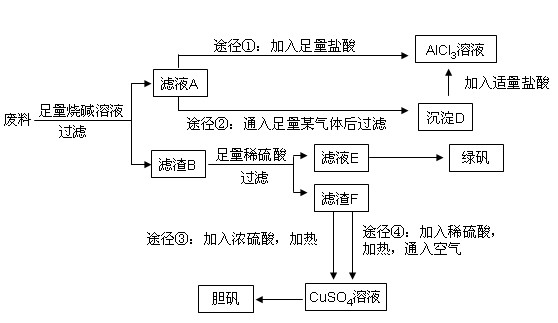
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式 。你认为较合理的途径是 (填①或②),理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了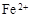 和
和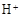 外,还可能存在 (用离子符号表示),检测该离子的方法是 。
外,还可能存在 (用离子符号表示),检测该离子的方法是 。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为___________、______________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:
ⅰ.H2O2ⅱ.调pHNaClO/NaOH混合溶液
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A~G各物质间的关系如下图,其中B、D为气态单质.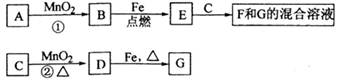
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①若能在常温下进行,其化学方程式为________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G,检验G溶液中阳离子的常用试剂是________,实验现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铝作为材料金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3。方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入________(一种过量的气体),该反应的离子方程式_______________________________________________。
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为_________。
(4)我国首创以铝、空气、海水为能源的新型电池。该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。这种海水电池的能量比“干电池”高20~50倍。该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光。该电池的总反应为:4Al+3O2+6H2O===4Al(OH)3。其负极材料为________,正极反应式为_________________。
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n)是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果。为确定碱式氯化铝分子式中的n值,可采用沉淀称量法。准确称取碱式氯化铝样品4.97 g,配制成500 mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液。然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35 g。该碱式氯化铝中的n=________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将质量为11.5 g钠和一定量的铝混合放入水中,充分反应共收集到12.32 L气体(标准状况),若反应后溶液的体积为1000 mL,则溶液中所有溶质的物质的量浓度为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu
的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答下列问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+(x+y)H2 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O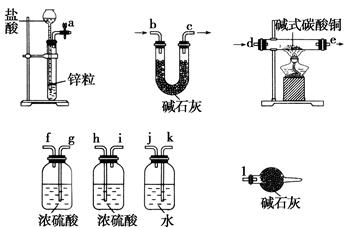
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙三种物质之间有如下转化关系: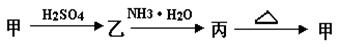
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_______ 。写出乙 丙转化的离子方程式 :________________________ 。
丙转化的离子方程式 :________________________ 。
(2)若乙溶液中加入KSCN溶液 ,有血红色出现,则甲物质是__________,乙物质的水溶液显 性(“酸”或“碱”),原因是 (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com