
���㣨�֣���1��1.01��105 Pa��273��ʱ��̬����Xn���ܶ�Ϊd g/L����X�����ԭ������Ϊ_________________��
��2����ͬ״���£�һ�������X����̬�⻯��HmX�������ǵ����NH3��2������X�����ԭ������Ϊ_______________________________��
��3��a��Xԭ�ӵ�������Ϊb g����X�����ԭ�������ɱ�ʾΪ____________________��
(4����״���£�1���ˮ�����ܽ�700���������������Һ���ܶ�Ϊ0.90 g��cm-3�������ð�ˮ�����ʵ���Ũ��Ϊ__________________��
��5����֪98%��ŨH2SO4��Һ�����ʵ���Ũ��Ϊ18.4 mol/L,���ж�49%��H2SO4��Һ�����ʵ���Ũ��______�������ڡ���С�ڡ����ڡ���9.2 mol/L

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
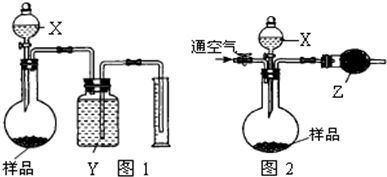
| ||
| m |
| ||
| m |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| tmin | Xmol | Ymol | Zmol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 2Z
2Z 2Z
2Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
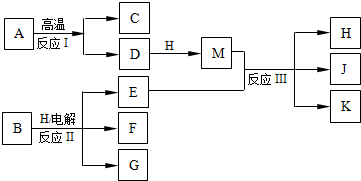


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
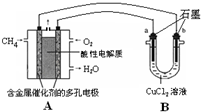 ��2013?����һģ����������Դ��ʹ�����ȼ�ϣ����Դﵽ�����Ч��������Ⱦ��Ŀ�ģ�
��2013?����һģ����������Դ��ʹ�����ȼ�ϣ����Դﵽ�����Ч��������Ⱦ��Ŀ�ģ�| 1 |
| 3 |
| 1 |
| 3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com