
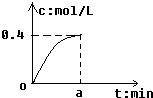 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
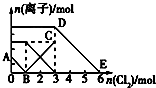 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法不正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法不正确的是( )| A. | 线段BC代表Fe3+物质的量的变化情况 | |
| B. | 原混合溶液中n(FeBr2)=3mol | |
| C. | 当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液pH时,pH试纸先用蒸馏水润湿 | |
| B. | 蒸馏实验中,蒸馏前必须在蒸馏烧瓶中加入碎瓷片 | |
| C. | 用盐酸滴定滴定氨水实验中,用甲基橙作指示剂以减小实验误差 | |
| D. |  用如图所示的方法排除碱式滴定管胶管中的气泡 用如图所示的方法排除碱式滴定管胶管中的气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中有水参加反应 | |
| B. | 反应后溶液呈无色 | |
| C. | 该反应的还原剂为K2S2O8 | |
| D. | MnSO4和K2S2O8的化学计量数分别为、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2O3、Fe3O4、FeO | B. | FeO、Fe3O4 | C. | Fe3O4、Fe2O3 | D. | FeO、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com