

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:不详 题型:填空题
| 滴定序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
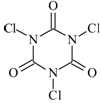
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
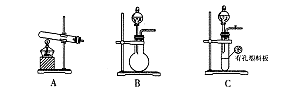
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
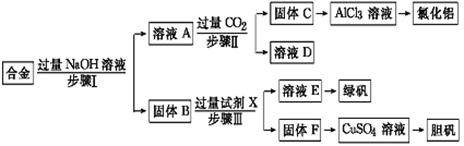
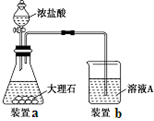

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
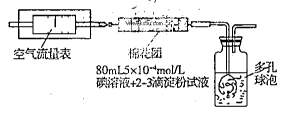
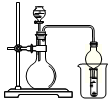
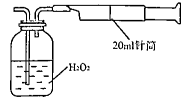 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
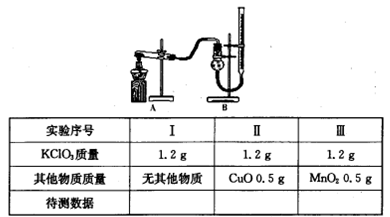
 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
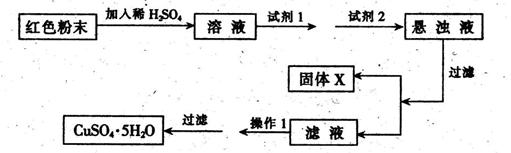
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
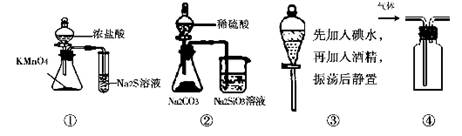
| A.用图①比较KMnO4、Cl2、S的氧化性 |
| B.用图②所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| C.用图③所示实验从碘水中萃取碘 |
| D.用图④所示实验装置排空气法收集CO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com