
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
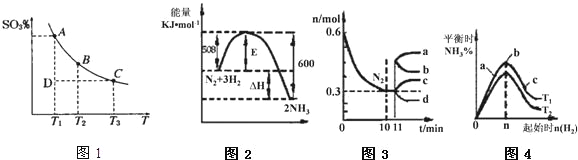
(1)硫酸生产过程中2SO2(g)+O2(g)2SO3(g),平衡混合体系中 SO3的百分含量和温度的关系如图1所示,根据图1回答下列问题:
①2SO2(g)+O2(g)2SO3(g)的△H____0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是____.
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4mol 电子,同时消耗2mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图2表示在此反应过程中的能量的变化,图3表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图4表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
①该反应的平衡常数表达式为_____,升高温度,平衡常数______(填“增大”或“减小”或“不变”).
②由图2信息,计算0~10min内该反应的平均速率v(H2)=______,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为______(填“a”或“b”或“c”或“d”).
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______点,温度T1______T2(填“>”或“=”或“<”).
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_____性,所得溶液中c(H+)﹣c(OH﹣)=_________________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
【答案】<beK=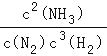 减小0.045mol/(Lmin)dc<酸性c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)或c(SO32﹣)+c(NH3H2O)﹣c(H2SO3)
减小0.045mol/(Lmin)dc<酸性c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)或c(SO32﹣)+c(NH3H2O)﹣c(H2SO3)
【解析】
①由图可知,温度越高SO3的含量越低,即升高温度平衡向逆反应移动,所以正反应是放热反应,△H<0;
②2SO2(g)+O2(g)![]() 2SO3(g),反应气体体积减小,气体质量不变;a.2SO2(g)+O2(g)2SO3(g),反应气体体积减小,气体质量不变,体系的密度不发生变化,所以体系的密度不发生变化,不能说明反应达到平衡状态,故a错误;b.SO2与SO3的体积比保持不变,反应达到平衡状态,故b正确;c.2SO2(g)+O2(g)2SO3(g),气体质量不变,S元素质量不变,体系中硫元素的质量百分含量不再变化,不能说明反应达到平衡状态,故c错误;d.任何状态下,单位时间内转移4mol 电子,同时消耗2mol SO3,不能说明反应达到平衡状态,故d错误;e.容器内的气体分子总数不再变化,说明各物质的浓度不变,说明反应达到平衡状态,故e正确;故答案为be;
2SO3(g),反应气体体积减小,气体质量不变;a.2SO2(g)+O2(g)2SO3(g),反应气体体积减小,气体质量不变,体系的密度不发生变化,所以体系的密度不发生变化,不能说明反应达到平衡状态,故a错误;b.SO2与SO3的体积比保持不变,反应达到平衡状态,故b正确;c.2SO2(g)+O2(g)2SO3(g),气体质量不变,S元素质量不变,体系中硫元素的质量百分含量不再变化,不能说明反应达到平衡状态,故c错误;d.任何状态下,单位时间内转移4mol 电子,同时消耗2mol SO3,不能说明反应达到平衡状态,故d错误;e.容器内的气体分子总数不再变化,说明各物质的浓度不变,说明反应达到平衡状态,故e正确;故答案为be;
(2)①N2(g)+3H2(g)![]() 2NH3(g),反应的平衡常数K=
2NH3(g),反应的平衡常数K=![]() ,图象1分析可知反应是放热反应,反应物能量高于生成物能量,温度升高平衡逆向进行,平衡常数减小;
,图象1分析可知反应是放热反应,反应物能量高于生成物能量,温度升高平衡逆向进行,平衡常数减小;
②图象分析2L的密闭容器中,V(N2)=![]() V(H2)=
V(H2)=![]() =0.015mol/Lmin,V(H2)=0.045mol/Lmin;
=0.015mol/Lmin,V(H2)=0.045mol/Lmin;
从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;
③图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2;
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈酸性,c(OH-)=c(H+),电解质溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-)得到:c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)。


科目:高中化学 来源: 题型:
【题目】(双选题)下列有关硫酸的化学事实与硫酸表现出的性质(括号中)的描述中,正确的是( )
A.久置在敞口容器中的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铁与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应的“黑面包”实验(吸水性)
D.浓硫酸与氯化钠固体反应制HCl(难挥发性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | C2H5OH(H2O) | 新制生石灰 | 蒸馏 |
D | 乙醇(乙酸) | 饱和Na2CO3溶液 | 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等.某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
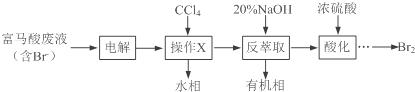
(1)操作X所需要的主要玻璃仪器为____________;反萃取时加入20%的NaOH溶液,其离子方程式为________________________.
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是_________.
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是____________________________.
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
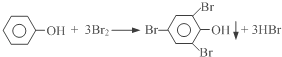
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:____________________________,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为____________mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量_________________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )
A.R的氧化物一定能溶于水
B.R的最高价氧化物对应水化物是H2RO3
C.R的氢化物的水溶液呈碱性
D.R的氧化物都能与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4—、C2O42—的浓度分数δ随溶液pH变化的关系如图,以下说法正确的是( )
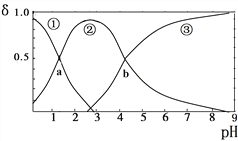
A. HC2O4—的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com