
| A组 | B组 | C组 | D组 | |
| 分类标准 | 碱 | 常温下为固体 | 金属单质 | 酸 |
| 不属于该类别的物质 | SO2 | Cl2 | H2 | H2O |
分析 (1)A.依据物质的性质:NaOH、Ca(OH)2、Fe(OH)3 都是碱,为氧化物SO2,解答;
B.依据物质的状态判断;
C.依据组成单质元素性质解答;
D.依据H2O为氧化物、HCl、H2SO4、HNO3为酸解答;
(2)水溶液中或者熔融状态下能够导电的化合物为电解质,电解质必须是化合物,据此判断;
(3)实验室用加热二氧化锰与浓盐酸的方法制取氯气,二者反应生成氯气、氯化锰和水.
解答 解:(1)A.NaOH、Ca(OH)2、Fe(OH)3 都是碱,为氧化物SO2,所以二氧化硫不属于该类物质;
B.Cl2常温下为气体;C、S、Cu常温下为固体,属于不同类的为Cl2:
C.Hg、Cu、Zn为金属单质,H2 为非金属单质,所以不同类的为H2;
D.H2O为氧化物、HCl、H2SO4、HNO3为酸,属于不同类的为:H2O;
故答案为:
| A组 | B组 | C组 | D组 | |
| 分类标准 | 碱 | 常温下为固体 | 金属单质 | 酸 |
| 不属于该类别的物质 | SO2 | Cl2 | H2 | H2O |
点评 本题考查了物质的分类,熟悉酸、碱盐、电解质、非电解质概念,明确相关物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间的变化而变化 | B. | X的消耗速率与Z的消耗速率相等 | ||
| C. | X、Y、Z、W的浓度相等 | D. | 总质量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用于制造光导纤维 | |
| B. | 盛氢氧化钠溶液的试剂瓶不能用玻璃塞 | |
| C. | 氯气可用于制取漂白粉 | |
| D. | 氢氧化铝可用于制造中和胃酸的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g NH3所含的电子数是 10NA | |
| B. | 常温常压下,22.4L氧气含氧原子数为2NA | |
| C. | 0.5 mol/L K2SO4溶液中含有NA个K+离子 | |
| D. | 2.3g金属钠与氧气反应全部生成Na2O时失去的电子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容量瓶中定容时,俯视刻度线 | |
| B. | 用量筒量取浓盐酸时,俯视刻度线 | |
| C. | 转移溶液后,未洗涤烧杯和玻璃棒就直接定容 | |
| D. | 定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
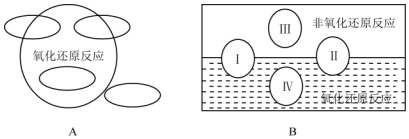 氧化还原是常见的反应类型,根据信息回答以下问题:
氧化还原是常见的反应类型,根据信息回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com