

| A. | 电池工作时,电子由a极经导线流向b极 | |
| B. | 交换膜a是阴离子交换膜 | |
| C. | 电极b的反应式:2NO3-+10e-+6H2O=N2↑+12OH- | |
| D. | 相同时间内(相同状况下)生成CO2和N2的体积比为5:2 |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,据此分析解答.
解答 解:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,
A、电子由负极a经导线流向正极b,故A正确;
B、该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,阳离子移向该电极,这边的交换膜是阳离子交换膜,所以左边离子交换膜为阴离子交换膜,右边离子交换膜为阳离子交换膜,故B正确;
C、则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,故C错误;
D、在转移120mol电子数相等的情况下:负极生成30mol的二氧化碳,正极生成12mol的氮气,所以生成CO2和N2的体积比为5:2,故D正确;
故选C.
点评 本题考查化学电源新型电池,题目难度中等,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,沸点依次升高 | |
| B. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏离子键和共价键 | |
| C. | 熔融状态下能导电的化合物一定含离子键 | |
| D. | CS2、BF3分子中所有的原子均为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精可以和水以任意比例互溶,与氢键有关 | |
| B. | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,与氢键有关 | |
| C. | 无机含氧酸的化学式可以用XOn(OH)m表示,n值越大,m值越小,则该酸的酸性就越强.则可推知,硫酸酸性强于磷酸 | |
| D. | 两分子 互为手性分子 互为手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用“地沟油”中油脂生产航空生物煤油 | |
| B. | 用细菌浸取法以含硫化铜贫矿制取铜盐 | |
| C. | 用水代替化工合成反应中某些有机 | |
| D. | 将废铅蓄电池深埋处理,节约回收成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
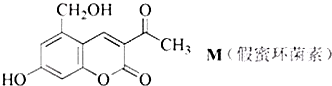
| A. | 在镍作催化剂并加热的条件下,1molM最多可与6molH2发生加成反应 | |
| B. | M不可能使酸性KMnO4溶液褪色 | |
| C. | M可在热的NaOH溶液中发生反应,最多可消耗3molNaOH | |
| D. | 1molM最多可与2molBr2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液滴定CH3COOH溶液,可选用甲基橙作指示剂 | |
| B. | 用量筒量20mL0.5000mol•L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 常温下,物质的量浓度均为0.1mol•L-1的盐酸、醋酸溶液,分别用水稀释100倍后pH的关系为:盐酸>醋酸 | |
| D. | 实验室常将氯化铁先溶于盐酸,再加水稀释来配制其溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的结构式: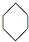 | |
| B. | 乙烯的结构简式C2H4 | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 羟基(-OH)的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com