
【题目】下列物质中,不属于合金的是()
A.硬铝B.黄铜C.不锈钢D.水银
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】浓氨水可用于检验氨气的泄漏,文献表明一定条件下NH3与C12可发生置换反应,某同学在实验室中对NH3与Cl2反应进行了探究。回答下列题:
(1)氯气的制备

①氯气的发生装置可以选择上图中的_______(填装置编号),反应的化学方程式为________。
②欲收集一瓶干燥、纯净氯气,选择上图中的装置部分装置可以重复使用,E装置中试剂可根据需要改变),其连接顺序为:发生装置→___按气流方向,用小写字母表示)。
(2)NH3与Cl2的反应
将上述收集到的Cl2连接在右图Y中,在注射器X中充入NH3(中间连接管用夹子K夹好)。按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K,推动注射器活塞,使少量NH3非常缓慢充入Y管中 | ①y管中.没有出现明显的白烟 | ②反应的化学方程式_____________ |
继续较快通入NH3 | Y管中产生较多白烟 | ③产生白烟的化学方程式_____________。 |
(3)实验设计:
①设计实验证明白烟所含物质中的阳离子__________。
②用(2)中装置设计实验证明氯元素比硫元索非金属性强__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。请回答下列问题:
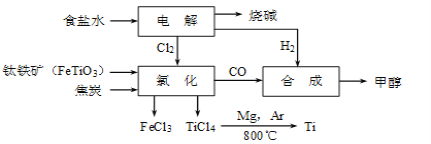
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式_______________。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:_________________________________________。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于___________℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) ![]() CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Al(OH)3]=1.0×10﹣33 , Ksp[Fe(OH)3]=4.0×10﹣38 . 向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( ) 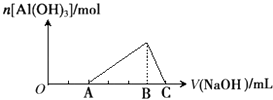
A.原混合溶液中c(Fe3+):c(Al3+)=1:1
B.Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去
C.B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104
D.C点溶液中的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
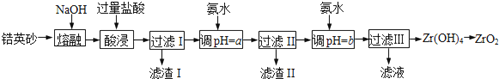
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海争端、南海仲裁案一直牵动国人的心,南海是一个巨大的资源宝库,海水开发利用的部分过程如下图所示。下列有关说法正确的是( )
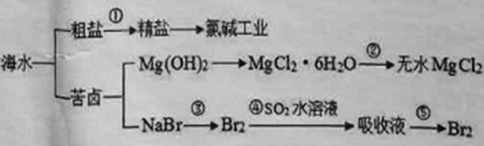
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入药品的顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液、过滤后加盐酸
B.第②步的关键要低温小火烘干
C.氯碱工业的阴极产物是Cl2
D.第③步到第⑤步的目的是为了富集溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 纯碱、烧碱均属碱 B. CO2属酸性氧化物
C. 凡能电离出H+的化合物均属酸 D. 凡能电离出OH—的化合物均属碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是

A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mol·L-1的盐酸10mL稀释到200mL,从中取出10mL的溶液的物质的量浓度是
A.0.05 mol·L-1B.0.25 mol·L-1
C.0.10 mol·L-1D.0.50 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com