
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1mol/L的①CH3COOH ②NH4Cl ③H2SO4三种溶液中,由水电离出的c(H+):①>③>② | |
| B. | 常温下,pH=2与pH=3的CH3COOH溶液,前者的c(CH3COOH)是后者的10倍 | |
| C. | 任意稀盐酸中c(H+)的精确计算式可以表示为c(H+)=c(Cl-)+Kw/c(OH-) | |
| D. | 同c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液,物质的量浓度最大的是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

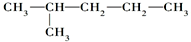 与
与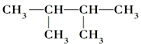
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
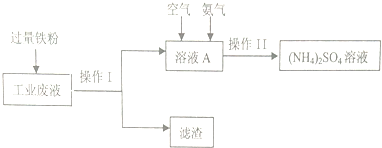
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物是指含氧元素的化合物 | B. | 氧化物、酸、碱、盐都含氧元素 | ||
| C. | 碱性氧化物一定是金属氧化物 | D. | 酸性氧化物一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
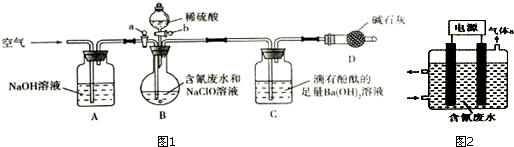
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com