
分析 (1)计算C原子孤电子对数、价层电子对数,进而确定CO32-的空间构型;
(2)CO2属于分子晶体,而SiO2属于原子晶体;
(3)甲醇分子中C原子形成4个共价键,没有孤电子对,杂化轨道数目为4;甲醇分子与水分子之间形成氢键,甲醇易溶于水;
(4)Co为27号元素,原子核外电子排布式为1s22s22p63s23p63d74s2,失去4s能级2个电子形成Co2+;Co3+填充于八面体空隙,则其周围O2-数目为6;
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2•6H2O);
(6)氧化亚钴的晶体结构与氯化钠类似,晶胞中O2-处于体心与棱中心,Co2+处于顶点与面心,若氧化亚钴晶体的晶胞边长为apm,O2-、Co2+之间距离为0.5a pm,顶点与面心的Co2+紧邻,其距离为O2-、Co2+之间距离的$\sqrt{2}$倍.
解答 解:(1)CO32-中C原子孤电子对数=$\frac{4×2-2×3}{2}$=0、价层电子对数=3+0=3,CO32-的空间构型为平面正三角形,
故答案为:平面正三角形;
(2)CO2属于分子晶体,而SiO2属于原子晶体,故SiO2熔点高,
故答案为:CO2属于分子晶体,而SiO2属于原子晶体;
(3)甲醇分子中C原子形成4个共价键,没有孤电子对,杂化轨道数目为4,C原子采取sp3杂化;甲醇分子与水分子之间形成氢键,甲醇易溶于水,
故答案为:sp3杂化;甲醇分子与水分子之间形成氢键;
(4)Co为27号元素,原子核外电子排布式为1s22s22p63s23p63d74s2,失去4s能级2个电子形成Co2+,Co2+的价层电子式为3d7;Co3+填充于八面体空隙,则其周围O2-数目为6,Co3O4晶体中Co3+的配位数为6,
故答案为:3d7;6;
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2•6H2O),该反应方程式为:CoO+2HCl+5H2O=CoCl2•6H2O,
故答案为:CoO+2HCl+5H2O=CoCl2•6H2O;
(6)氧化亚钴的晶体结构与氯化钠类似,晶胞中O2-处于体心与棱中心,Co2+处于顶点与面心,若氧化亚钴晶体的晶胞边长为apm,O2-、Co2+之间距离为0.5a pm,顶点与面心的Co2+紧邻,其距离为O2-、Co2+之间距离的$\sqrt{2}$倍,即两个紧邻的Co2+之间的距离为$\sqrt{2}$×0.5a pm=$\frac{\sqrt{2}}{2}$a pm,
故答案为:$\frac{\sqrt{2}}{2}$a.
点评 本题是对物质结构与性质的考查,涉及空间构型与杂化方式判断、核外电子排布、氢键、晶胞结构及计算等,属于拼合型题目,(6)中计算为易错点,需要学生熟练识记中学常见晶胞结构,具备一定的空间想象与数学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 其密度之比等于对应的物质的量之比 | |
| B. | 其质量之比等于相对分子质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量的倒数之比 | |
| D. | 等体积的三种气体,其物质的量比等于相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+):③>① | |
| B. | 水电离出的c(H+):②>① | |
| C. | ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH与CH3CH2OCH3 | B. |  与 与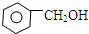 | ||
| C. | CH3COOH与HCOOCH2CH3 | D. | CH3CH2CH2CHO与(CH3)2CHCH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,4v(O2)正=5v(NO)逆 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com