
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO47H2O晶体,其流程图如下:

回答下列问题:

(1)“碱浸”时发生反应的离子方程式为______。
(2)“酸浸”所使用的酸为______。
(3)“净化除杂”需加入H2O2溶液,其作用是______。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+2OH-=2AlO2-+H2O H2SO4 将Fe2+氧化为Fe3+ c(OH-)= mol/L=10-11.3mol/L,pH=14+lgc(OH-)=2.7 冷却结晶 2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O NiOOH+e-+H2O=Ni(OH)2+OH-
mol/L=10-11.3mol/L,pH=14+lgc(OH-)=2.7 冷却结晶 2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O NiOOH+e-+H2O=Ni(OH)2+OH-
【解析】
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质,目的是用含镍废催化剂制备NiSO47H2O晶体,分析工艺流程,将含Ni废催化剂碱浸,Al和Al2O3溶于碱生成AlO2-,进行过滤,则Fe、Ni及其他不溶于碱的杂质被过滤出,进行酸浸,则Fe和Ni溶于酸形成![]() 和
和![]() ,进行过滤操作,则不溶于酸的杂质被过滤出,滤液中主要含有Fe2+和Ni2+,净化除杂主要除去Fe元素得到Ni元素的溶液,经过后续处理得到NiSO47H2O。
,进行过滤操作,则不溶于酸的杂质被过滤出,滤液中主要含有Fe2+和Ni2+,净化除杂主要除去Fe元素得到Ni元素的溶液,经过后续处理得到NiSO47H2O。
(1)“碱浸”时Al和Al2O3溶于碱生成AlO2-,则发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑ , Al2O3+2OH-=2AlO2-+H2O;
(2)工艺流程最终目的是制备NiSO47H2O晶体,所以酸浸时所用的酸应为H2SO4;
(3)加入的H2O2具有氧化性,可将Fe2+氧化为Fe3+,Fe3+更易形成Fe(OH)3而去除Fe元素的;溶液中c(Fe3+)浓度低于10-5mol/L,认为Fe3+几乎完全被除去,此时溶液中c(OH-)= mol/L=
mol/L=![]() =10-11.3mol/L,pH=14+lgc(OH-)=14+lg10-11.3=2.7;
=10-11.3mol/L,pH=14+lgc(OH-)=14+lg10-11.3=2.7;
(4)含有NiSO4的溶液,经过加热浓缩和操作A得到NiSO47H2O晶体,则操作A为冷却结晶;
(5)NiSO4在强碱性溶液中被NaClO氧化为NiOOH,而ClO-被还原为Cl-,反应的离子方程式为:2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O;
(6)NiOOH可作为镍氢电池的电极材料,原电池正极发生还原反应,NiOOH放电转化为Ni(OH)2,溶液呈碱性,则生成OH-,电极反为NiOOH+e-+H2O=Ni(OH)2+OH-。


科目:高中化学 来源: 题型:
【题目】下列说法或表示法不正确的是( )
A.1mol硫蒸气与2mol硫蒸气完全燃烧时,燃烧热相同
B.已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(aq)△H=-57.3kJ·mol-1,若将含1molCH3COOH的稀醋酸溶液与含1molBa(OH)2的稀溶液混合,放出的热量小于57.3kJ
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol;Ⅱ:![]() ,
,![]() ,且a、b、c均大于零,则断开1mol H-Cl键所需的能量为2(a-b-c) kJ/mol
,且a、b、c均大于零,则断开1mol H-Cl键所需的能量为2(a-b-c) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原性糖,而其水解产物具有还原性的实验方案的说法正确的是( )。

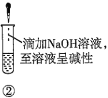


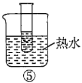
A.验证蔗糖属于非还原性糖的操作顺序:④③
B.验证蔗糖風于非还原性糖的操作顺序:④②③
C.验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D.验证蔗糖水解产物具有还原性的操作顺序:①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置进行乙醇的催化氧化实验。
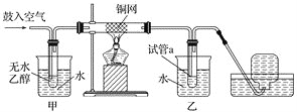
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。
(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )

A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
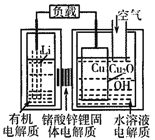
A. 放电时,当电路中通过0.1 mol电子的电量时,有0.1molLi+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B. 整个反应过程中,氧化剂为O2
C. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.12g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com