
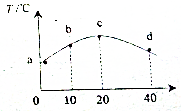
 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
分析 根据当加入20mLNaOH溶液时,溶液的温度最高,则说明此时NaOH和HNO2恰好完全反应,故C(NaOH)=0.01mol/L.
A、HNO2的电离是吸热过程,温度越高电离平衡常数越大;
B、b点时,加入的n(NaOH)=$\frac{1}{2}$n(HNO2),根据物料守恒来分析;
C、c点溶液中,n(NaOH)=n(HNO2),两者恰好完全反应生成NaNO2,为强碱弱酸盐,据此分析;
D、在d点溶液中,NaOH过量,溶液中n(NaOH)=n(NaNO2),根据电荷守恒和物料守恒来分析.
解答 解:根据当加入20mLNaOH溶液时,溶液的温度最高,则说明此时NaOH和HNO2恰好完全反应,故C(NaOH)=0.01mol/L.
A、HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c高于b,所以电离平衡常数:c点>b点,故A正确;
B、b点时,加入的n(NaOH)=$\frac{1}{2}$n(HNO2),HNO2反应后部分反应为NaNO2,即溶液中含有HNO2和NaNO2,但无论以哪种形式存在,均满足物料守恒,即有:2c(Na+)=c(NO2-)+c(HNO2),故B正确;
C、c点溶液中,加入的氢氧化钠的物质的量n(NaOH)=n(HNO2),两者恰好完全反应生成NaNO2,为强碱弱酸盐,NO2-存在微弱的水解,溶液显碱性,故有:c(Na+)>c(NO2-)>c(OH-)>c(H+),故C错误;
D、在d点溶液中,加入的氢氧化钠的物质的量是HNO2的物质的量的2倍,即n(NaOH)=2n(HNO2),反应后,溶液中的C(NaOH)=C(NaNO2);则反应后溶液中存在电荷守恒:c(Na+)+c(H+)=c(NO2-)+c(OH-) ①
还存在物料守恒:c(Na+)=2c(NO2-)+2c(HNO2) ②
将①-②可得:c(OH-)=c(H+)+c(NO2-)+2c(HNO2),故D错误.
故选CD.
点评 本题是根据图象分析离子的浓度之间的关系,解题的关键是根据图象中温度的变化来确定,确定物质的反应实质是解题的关键.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A=1×10-4B | B. | B=1×10-4A | C. | A>B | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在碱性溶液中,Na+、S2-、K+、AlO2- | |
| B. | 在酸性溶液中,SO32-、S2-、K+、NH4+ | |
| C. | 在酸性溶液中,Fe2+、Cu2+、Cl-、NO3- | |
| D. | 在酸性溶液中,Fe2+、Cl-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转化为Fe3O4,失去8NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com