
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 | 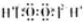 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaClO中钠离子和次氯酸根离子之间存在离子键、O-Cl原子之间存在共价键,次氯酸钠具有强氧化性而使蛋白质变性;
B.双氧水是共价化合物,只存在共价键;
C.氨气中只含共价键,氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子而使其水溶液呈溶解性,工业制取硝酸的原料是氨气;
D.碳酸氢钠属于强碱弱酸酸式盐,能和铝离子发生双水解反应而生成二氧化碳.
解答 解:A.NaClO中钠离子和次氯酸根离子之间存在离子键、O-Cl原子之间存在共价键,次氯酸钠具有强氧化性而使蛋白质变性,所以可以作消毒剂,故A正确;
B.双氧水是共价化合物,只存在共价键,其电子式为 ,故B错误;
,故B错误;
C.氨气中只含共价键,氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子而使其水溶液呈弱碱性,该现象属于化学性质,故C错误;
D.碳酸氢钠属于强碱弱酸酸式盐,能和铝离子发生双水解反应而生成二氧化碳,与其稳定性强弱无关,故D错误;
故选A.
点评 本题考查较综合,涉及化学键、电子式、物质性质及用途等知识点,明确物质组成、结构、性质和用途之间关系是解本题关键,易错选项是C,题目难度不大.


科目:高中化学 来源: 题型:解答题
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
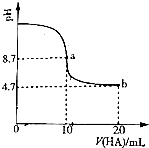
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别与滴有酚酞的NaOH溶液共热可区别煤油与植物油 | |
| B. | 煤含有苯、甲苯等,先干馏后分馏获可得苯、甲苯等芳香烃 | |
| C. | 在水电离出H+浓度为1×10-12mol/L溶液中一定大量存在Fe2+、Na+、NO3-、Cl- | |
| D. | 在NH4HSO3溶液中加入少量NaOH溶液反应的离子方程式为NH4++OH-=NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,氧化剂为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
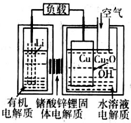
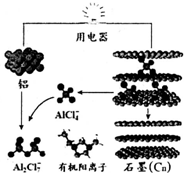 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时的阳极反应为:Cn+AlCl4--e-=Cn AlCl4 | |
| C. | 放电时的负极反应为:Al-3e-+7 AlCl4-═4A12C17- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物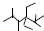 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 用甘氨酸[H2N-CH2-COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽 | |
| D. | 乙醇、乙二醇、丙三醇的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物XW中含有共价键 | |
| B. | 化合物ZW中含有离子键 | |
| C. | X和Z可以形成离子化合物ZX | |
| D. | 化合物ZYX和ZYW所含有的键型不一样 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com