
| A. | 硅胶可用作食品干燥剂和催化剂的载体 | |
| B. | 铝盐、铁盐净水原理与氯气净水原理相同 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| D. | 电解熔融NaC1或A1C13制取Na或A1 |
分析 A.硅胶具有吸水性;
B.依据盐类水解的应用解答;
C.乙烯具有催熟效力,能够被高锰酸钾氧化;
D.熔融氯化铝不导电.
解答 解:A.硅胶具有吸水性,且无毒,所以可以做干燥剂,故A正确;
B.铝盐、铁盐净水是因为二者水解生成具有吸附性的氢氧化铝胶体、氢化氧化铁胶体,能够吸附水中固体杂质颗粒而净水,氯气与水反应生成具有强氧化性次氯酸,具有杀菌消毒作用,故B错误;
C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了氧化生成的具有催熟效力的乙烯,故C错误;
D.熔融氯化铝不导电,工业制备铝用电解氧化铝方法,故D错误;
故选:A.
点评 本题考查了物质的结构、组成与用途,明确盐类水解的性质及应用,熟悉相关物质的性质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 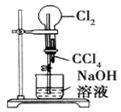 打开止水夹,挤压装置如图的胶头滴管使CCl4全部进入烧瓶 | |
| B. | 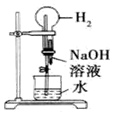 打开止水夹,挤压如图装置的胶头滴管使NaOH溶液全部进入烧瓶 | |
| C. | 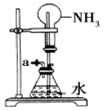 打开止水夹,用鼓气装置从如图装置的a处不断鼓入空气 | |
| D. |  打开止水夹,向如图装置的水槽中慢慢加入足量浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 胶体粒子比较小,可以通过半透膜 | |
| D. | 电泳现象可证明胶体属于电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
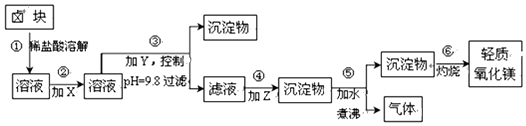
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的电离方程式为:NaHCO3═Na++H++CO32- | |
| B. | 离子浓度关系:c(Na+ )+c(H+ )═c(OH- )+c(HCO3- )+c(CO32-) | |
| C. | 25℃时,加水稀释后,n (H+)与n(OH-)的乘积变大 | |
| D. | 温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| B. | 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热 | |
| C. | 海底可燃冰开发不当释放出的甲烷会造成温室效应的加剧 | |
| D. | 可以用钢瓶储存液氯或浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
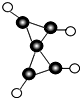 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )| A. | 该分子的分子式C5H4 | |
| B. | 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2 | |
| C. | 该物质完全燃烧生成的CO2与H2O的分子数比为5:4 | |
| D. | 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 水中含有的氧原子数约为6.02×1023 | |
| B. | 常温下,等物后的量的甲烷和一氧化碳所含有对分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气对质量小 | |
| D. | 气体摩尔体积是指1mol任何气体所占的体积,约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com