
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题
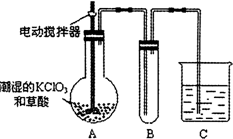 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
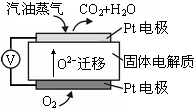 淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
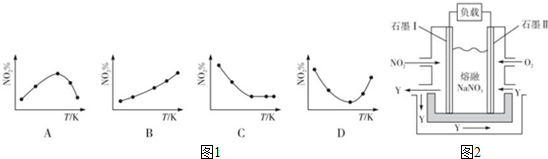
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无机物的种类比有机物多 | |
| B. | 互为同系物的有机物有可能同时互为同分异构体 | |
| C. | 丁烷有两种同分异构体 | |
| D. | 醇和醚均互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同 | |
| B. | 常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应 | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO42- | |
| D. | 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com