
| A. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)>c(CH3COO-)+c(OH-) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
科目:高中化学 来源: 题型:选择题
| A. | 所有的烷烃,彼此都是同系物 | |
| B. | 两种化合物的组成元素相同,各元素的质量分数也相同,二者一定具有相同最简式 | |
| C. | 组成元素的质量分数相同的不同化合物互为同分异构体 | |
| D. | 互为同系物的有机物相对分子质量一定相差14的整数倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀硝酸 | 有气体产生,说明样品中含有Na2CO3 |
| ② | 向试管中加入足量Ba(NO3)2溶液 | 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4 |
| ③ | 若②操作无沉淀,则向试管中加入0.1mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1mol•L-1AgNO3溶液 | 有沉淀产生,则含NaCl;无沉淀产生,则不含NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
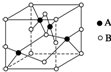 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中,两个O之间形成2对共用电子对 | |
| B. | N2的电子式是N┇┇N | |
| C. | CO2和CS2都是直线型分子 | |
| D. | 白磷和甲烷都是正四面体型,键角都是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比液态水的密度小是因为冰分子之间含有较强的化学键 | |
| B. | 氨分子的键角比甲烷分子的键角小是因为两个分子中中心原子的杂化方式不同 | |
| C. | HF的沸点比HCl的沸点高是因为HF分子内含有氢键 | |
| D. | HF比HCl稳定是因为HF分子中共价键的键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com