
已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是

A.x数值为1.4×10-5
B.b点与d点对应的溶度积相等
C.加入蒸馏水可使溶液由d点变到a点
D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等
B
【解析】
试题分析:CaCO3在水中的沉淀溶解平衡为CaCO3(s) Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4 mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5 mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5 mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4 mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5 mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5 mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
考点:考查难溶电解质的溶解平衡及沉淀转化等


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:简答题
.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
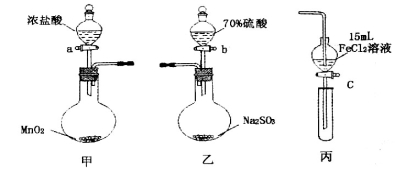
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:

上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省江门市高二调研测试理综化学试卷(解析版) 题型:选择题
下列物质中,能够发生水解的高分子化合物有
A.聚乙烯 B.蛋白质 C.淀粉 D.油脂
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
锗(Ge)是第四周期第IVA族元素,处于元素周期表中金属区与非金属区的交界线处,下列叙述正确的是( )
A.锗是一种金属性很强的元素 B.锗的单质具有半导体的性能
C.锗化氢(GeH4)稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省揭阳市高三4月第二次模拟理综化学试卷(解析版) 题型:实验题
(16分)利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
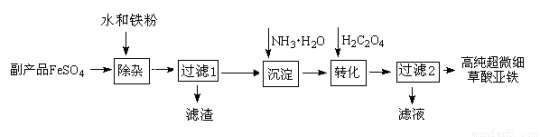
(1)检验FeSO4是否已有部分氧化的方法是 。
(2)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。请补充化学方程式:
TiOSO4 + =H2SO4 + H2TiO3↓;铁粉的作用有:①除去溶液中的Fe3+,② 。
(3)沉淀反应的离子方程式是 。
(4)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致FeC2O4的产率______(填“偏高”、“偏低”或“无影响”)。
(5)过滤2得到的滤液经蒸发浓缩、 、洗涤可得到副产品,该物质可用作 (写出一种用途)。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省揭阳市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的
A.“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害
B.明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用
C.红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应
D.含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
下列各组原子序数表示的两种元素中,能够形成共价化合物的是
A.11与17 B.11与10 C.1与17 D.1与8
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
在可逆反应2SO2+O2 2SO3中,充入一定量的18O2,足够长的时间后,18O原子
2SO3中,充入一定量的18O2,足够长的时间后,18O原子
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于O2和SO2中 D.存在于O2、SO2和SO3中
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:填空题
2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 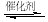 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:

①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g)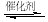 N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
A.增加原催化剂的表面积 B.降低温度
C. 减小投料比[n(NO2) / n(CH4)] D.增大压强
(3)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生上述的两个反应:并在t秒时测定其中NOx转化率,绘得图象如图所示:

从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com