
| A. | 此时a+b的值是大于14 | |
| B. | 反应后溶液呈中性 | |
| C. | 反应后溶液中由水电离的c(H+)小于10-7mol/L | |
| D. | 反应前醋酸和NaOH对水的电离影响程度一样 |
分析 25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应生成醋酸钠,溶液显碱性,醋酸溶液中氢离子浓度小于氢氧化钠溶液中氢氧根离子浓度,
A.25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应生成醋酸钠,溶质物质的量相同,溶液中氢离子浓度小于氢氧根离子浓度;
B.溶液显碱性;
C.生成醋酸钠溶液中醋酸根离子水解,促进水的电离;
D.醋酸溶液中氢离子浓度小于氢氧化钠溶液中氢氧根离子浓度,对水的抑制程度小.
解答 解:25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应生成醋酸钠,溶液显碱性,醋酸溶液中氢离子浓度小于氢氧化钠溶液中氢氧根离子浓度,
A..25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应生成醋酸钠,溶质物质的量相同,溶液中氢离子浓度小于氢氧根离子浓度,10-a<$\frac{1{0}^{-14}}{1{0}^{-b}}$,此时a+b的值是大于14,故A正确;
B.25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应生成醋酸钠,溶液显碱性,故B错误;
C.生成醋酸钠溶液中醋酸根离子水解,促进水的电离,反应后溶液中由水电离的c(H+)大于10-7mol/L,故C错误;
D.醋酸溶液中氢离子浓度小于氢氧化钠溶液中氢氧根离子浓度,对水的抑制程度小,反应前醋酸和NaOH对水的电离影响程度不一样,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡、酸碱反应后溶液酸碱性判断、影响谁电离平衡因素分析,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、ClO-、Cl- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
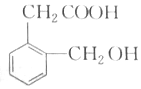 ),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.
),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 |  | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
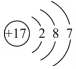 ④
④ ⑤二⑥ⅠA⑦ⅥA
⑤二⑥ⅠA⑦ⅥA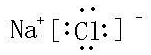 ,属于离子(离子或共价)化合物.
,属于离子(离子或共价)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com