
 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0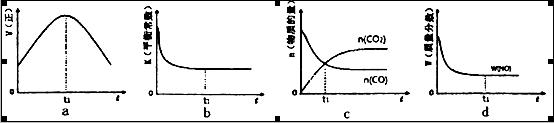
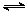 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②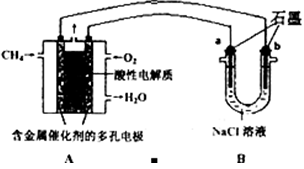


科目:高中化学 来源:不详 题型:单选题
| A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 |
| B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42-向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图①中正极附近溶液pH降低 |
| B.图①中电子由Zn流向Cu,盐桥中的Cl—移向CuSO4溶液 |
C.图②正极反应是O2+2H2O+4e¯ 4OH¯ 4OH¯ |
| D.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
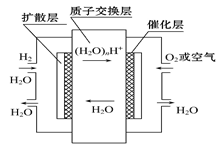
| A.正极通入H2,发生还原反应 |
| B.负极通入H2,发生还原反应 |
| C.导电离子为质子,且在电池内部由正极定向移向负极 |
| D.总反应式为2H2+O2 = 2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图1为原电池装置,Cu电极上产生的是O2 |
| B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+ |
| C.由实验现象可知:金属活动性Cu>Cr |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
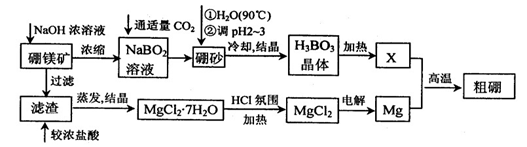
 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
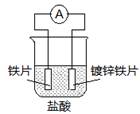
| A.溶液中pH值明显下降 |
| B.铁片为正极,镀锌铁片为负极 |
| C.阴极的电极反应式:Fe-2e→Fe2+ |
| D.电子由锌经溶液流向铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com