
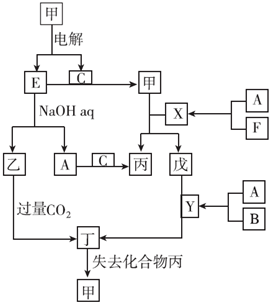
分析 A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,六种元素都不在同一主族.电解甲到得到单质E与气体单质C,E能与氢氧化钠溶液反应生成乙与气体单质A,则E为Al、乙为NaAlO2、A为H2、甲为Al2O3、C为O2,由转化关系可知,丁为Al(OH)3,丙为H2O,F的原子序数大于Al,则F为Cl2,B的原子序数小于氧元素,且单质为气体,故B为N2,D与H、Cl不在同一主族,原子序数小于Al,大于氧,故D为Mg,则X为HCl、Y为NH3、戊为AlCl3,据此解答.
解答 解:A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,六种元素都不在同一主族.电解甲到得到单质E与气体单质C,E能与氢氧化钠溶液反应生成乙与气体单质A,则E为Al、乙为NaAlO2、A为H2、甲为Al2O3、C为O2,由转化关系可知,丁为Al(OH)3,丙为H2O,F的原子序数大于Al,则F为Cl2,B的原子序数小于氧元素,且单质为气体,故B为N2,D与H、Cl不在同一主族,原子序数小于Al,大于氧,故D为Mg,则X为HCl、Y为NH3、戊为AlCl3.
(1)由上述分析可知.甲为氧化铝,乙为偏铝酸钠,故答案为:氧化铝;偏铝酸钠;
(2)实验室制取F(氯气)的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,检验氯气收集满的方法:将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满;
(3)氨气和CuO的反应方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)偏铝酸钠和过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)Mg和Al形成原电池的两个电极,NaOH溶液是电解质溶液,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极,Mg为正极,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:负极;Al+4OH--3e-=AlO2-+2H2O;
(6)73 g HCl物质的量为2mol,与足量的NaOH溶液反应放热Q kJ,1molHCl反应放出热量为0.5Q kJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-0.5Q kJ/mol,
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-0.5Q kJ/mol;
(7)D的最高价氧化物对应水化物Mg(OH)2的Ksp=1.8×10-11,该物质的溶液中,要使Mg2+离子 的浓度降至1.8×10-9 mol/L,则c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{1.8×1{0}^{-9}}}$mol/L=0.1mol/L,溶液中c(H+)=10-13mol/L=0.1mol/L,则溶液pH=-lg10-13=13,
故答案为:13.
点评 本题考查无机物推断,转化中E与氢氧化钠反应为推断突破口,熟练注意短周期元素,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
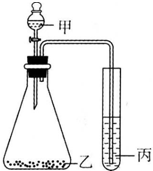
| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
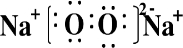 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
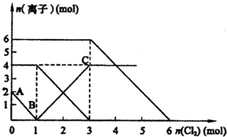 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:2:3 | |
| C. | 原混合溶液中FeBr2的物质的量为6 mol | |
| D. | 当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
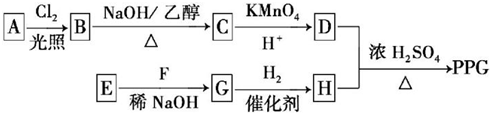
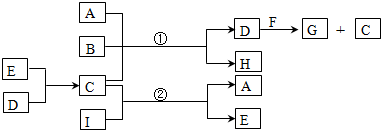
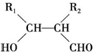 .
. .
. ,反应类型为消去反应.
,反应类型为消去反应. .
. (写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).
(写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com