
下列关于1.0mol•L﹣1Na2SO4溶液的叙述正确的是( )
①溶液中含有1mol Na2SO4
②1L溶液中含有142g Na2SO4
③将1mol Na2SO4溶于1mol水中所得的溶液
④将322g Na2SO4•10H2O溶于水后再稀释成1 000mL所得的溶液.
A.①③ B.②④ C.③④ D.②③
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:选择题
在0.1 mol•L﹣1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO﹣+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol•L﹣1 HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市名校高一下联考化学试卷(解析版) 题型:选择题
自然环境与人们的生活息息相关.下列有关说法中,不正确的是( )
A.废旧显示器必须回收,其主要目的是为了提取其中的贵重金属
B.生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染
C.二氧化碳和甲烷等会导致“温室效应”,从而引起全球变暖
D.雾霾天气会造成严重的交通问题,雾霾是一种胶体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下开学化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下开学化学试卷(解析版) 题型:选择题
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:填空题
第四周期中的18种元素具有重要的用途,在现代工业中备受青睐.
(1)铬是一种硬而脆,抗腐蚀性强的金属,常用于电镀和制造特种钢.基态Cr原子中,电子占据最高能层的符号为 ,该能层上具有的原子轨道数为 ,电子数为 .
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律? (填“是”或“否”),原因是 (如果前一问填“是”,此问可以不答).
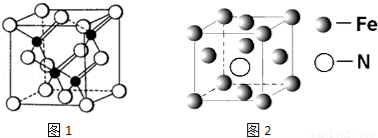
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与 个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为 .
(4)与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型 ,一定压强下将AsH3和NH3、PH3的混合气体降温是首先液化的是
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学式为 ;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为 g.cm﹣3(用含a和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
下列关于晶体的说法一定正确的是( )
A.分子晶体中都存在共价键
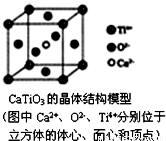
B.CaTiO3晶体中每个Ti4+和12个O2﹣相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
关于乙烯分子中有5个σ键、一个π键,下列说法正确的是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C、H之间形成的是s﹣p σ键,C、C之间的π键是未参加杂化的2p轨道形成的
D.C、C之间形成的是sp2﹣sp2σ键,C、H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下4月月考化学试卷(解析版) 题型:实验题
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢; 与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
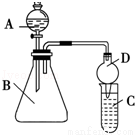
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律:
(3)仪器B的名称为 ,干燥管D的作用为 .
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液 的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶除去.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com