
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
【答案】D
【解析】
A、燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态而不能为气态,所以甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3kJ/mol,故A错误;
B. 因为一定条件下,N2(g)+3H2(g)![]() 2NH3(g)为可逆反应,△H指的是反应热,是指1molN2和3molH2完全反应放出的热量,所以该反应放出的热量大于38.6kJ/mol,即△H<﹣38.6kJ/mol,故B错误;
2NH3(g)为可逆反应,△H指的是反应热,是指1molN2和3molH2完全反应放出的热量,所以该反应放出的热量大于38.6kJ/mol,即△H<﹣38.6kJ/mol,故B错误;
C. 已知2C(s)+2O2(g) ═2CO2(g) △H1和2C(s)+O2(g)=2CO(g) △H2和2CO(g)+O2(g)=2CO2(g) △H3都属于放热反应,且△H1=△H2+△H3,所以△H1<△H2,故C错误;
D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol,所以D选项是正确的;
所以答案:D。


科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
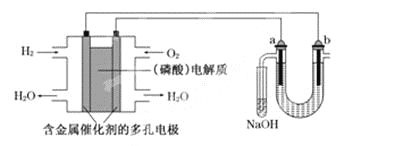
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对二乙烯苯(如图)可用作树脂、油漆及特种橡胶的原料。下列说法正确的是
![]()
A.分子中所有原子可能共平面B.易溶于甲苯,沸点比甲苯低
C.不能使稀酸性高锰酸钾溶液褪色D.1 mol该物质至多可与2 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌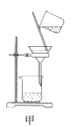
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag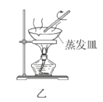
C.用装置丙制备Cl2 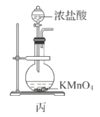
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如图:
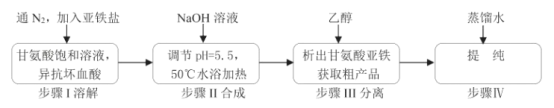
已知:

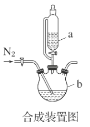
请回答:
(1)合成装置中仪器b的名称是___。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___。
(3)写出水浴加热过程中生成甘氨酸亚铁络合物的离子方程式___。
(4)下列说法正确的是___。
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ中的分离方法是过滤
D.步骤IV,提纯操作中的干燥过程最好选用真空干燥
(5)合成过程需控制pH=5.5,试说明理由___。
(6)步骤Ⅲ加入无水乙醇的目的是___。
(7)若甘氨酸的投料量为300kg,得到纯品344.8kg,则产品的产率为___ %(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl26H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如图:
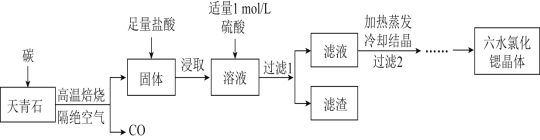
已知:①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质。
②BaSO4的溶度积常数为1.1×10-10,SrSO4的溶度积常数为3.3×10-7。
③SrCl26H2O的摩尔质量为267g/mol。
(1)工业上天青石焙烧前应先研磨粉碎,其目的是__。
(2)工业上天青石隔绝空气高温焙烧时,若0.5molSrSO4中只有S元素被还原,且转移了4mol电子。则该反应的化学方程式为__。
(3)浸取后加入硫酸的目的是 用离子方程式表示 __。为了提高原料的利用率,滤液中Sr2+的浓度应不高于__mol/L。
(注:此时滤液中Ba2+浓度为1.0×10-5mol/L)。
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液。溶液中除Cl-外,不含其它与Ag+反应的离子 ,待Cl-完全沉淀后,滴入1—2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。已知:SCN-先与Ag+反应。
①滴定反应达到终点的现象是__。
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl26H2O的质量百分含量为___(保留3位有效数字)。
(5)由SrCl26H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若反应2NO(g)+O2(g)![]() 2NO2的平衡常数为K1,2NO2(g)
2NO2的平衡常数为K1,2NO2(g)![]() N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)
N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)![]() N2O4(g)的平衡常数K=___。
N2O4(g)的平衡常数K=___。
(2)25℃、101KPa时,1Kg乙醇充分燃烧后放出的热量为29714kJ,则乙醇的燃烧热△H=__。
(3)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关是___。
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为__态。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com