
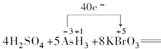 ,故答案为:
,故答案为: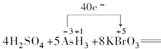 .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
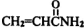 )具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.
)具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.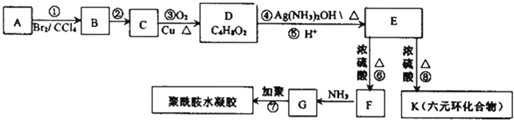
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤⑥ | B、③④⑤⑥ |
| C、只有①③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | ||||
| B、在AgCl沉淀中加入碘化钾溶液:AgCl(s)+I-(aq)═AgI (s)+Cl-(aq) | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
D、电解氯化镁溶液:2Cl-+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com