
(10分)1000℃时,硫酸钠可与氢气发生反应: Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g)。请回答下列问题:
Na2S(s)+4H2O(g)。请回答下列问题:
 (1)上述反应的平衡常数表达式为: 。
(1)上述反应的平衡常数表达式为: 。
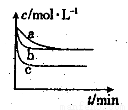
(2)上述反应在三个不同条件下进行,与曲线a比较,b和c分别仅改变一种反应条件,其中H2的浓度随时间的变化如图所示。
①则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”)。
(3)该温度下,向2 L盛有1.42 g Na2SO4的密闭恒容容器中通入H2,5 min
后测得固体质量为1.10 g。
①则该时间范围内的平均反应速率v(H2)= 。
②能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内压强保持不变 B.容器内气体密度保持不变
C.c (H2)=c (H2O) D.v正(H2)=v逆(H2O)
(1)c 4(H2O)/ c 4(H2)
(2)①使用催化剂 ② >。
(3)①0.002 mol/(L.min) ; ② B、D 。
【解析】
试题分析::(1)根据题给化学方程式结合平衡常数表达式的书写原则写出上述反应的平衡常数表达式为:c4(H2O)/c4(H2);(2)①根据题给图像分析,与曲线a比较,曲线b缩短了达平衡的时间,氢气的平衡浓度未发生变化,则曲线b改变的条件为使用催化剂;②与曲线a比较,曲线c缩短了达平衡的时间,氢气的平衡浓度减小,则曲线c改变的条件为升高温度; 温度升高,达平衡时间缩短,平衡时H2浓度减少,说明升高温度平衡向正反应方向移动。该反应的△H>0;(3)①该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得固体质量为1.10g,固体质量减少0.32g,利用差量法计算,则该时间范围内参加反应氢气的物质的量0.02mol,根据v=△n/V△t计算,则该时间范围内的平均反应速率v(H2)=0.002mol/(L.min);②A、该反应为反应前后气体物质的量不变的反应,容器内压强不随反应的进行而变化,不能作为平衡标志,错误;B、容器内气体密度随反应的进行而变化,密度不变已达平衡,正确;C、达平衡后c(H2)和c(H2O)不一定相等,错误;D、v正(H2)=v逆(H2O),说明反应已达平衡,正确;答案选B、D。
考点:化学平衡常数、反应速率


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列有关物质与其用途(括号内为用途)对应关系不正确的是
A.SiO2(制光纤)
B.Si和Ge(半导体材料)
C.钢化玻璃(汽车窗玻璃)
D.氮化硅陶瓷(制导热剂)
查看答案和解析>>
科目:高中化学 来源:2014秋福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列物质中既能与盐酸又能与氢氧化钠溶液反应的是
A.CO2 B.Fe2O3 C.Al2O3 D.CuO
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
下列溶液中,一定能大量共存的离子组是
A.无色溶液中:Na+、MnO4-、SO42-、K+
B.使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH-
C.加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl-
D.含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
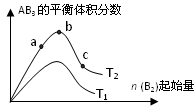
A.反应速率a>b>c
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b > c > a
D.达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
在除杂质过程中要尽量除去杂质,那么加入的试剂必须过量,最后过量试剂用物理或化学方法除去。现要除去NaCl溶液中的CaCl2、Na2SO4,下列选用试剂和使用顺序正确的是
A.Na2CO3、BaCl2、HCl B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl D.Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:实验题
(12分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
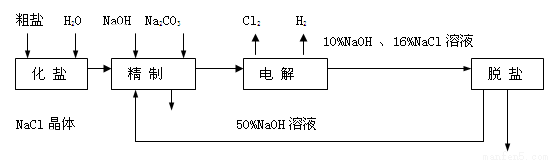
依据上图,完成下列填空:
(1)写出电解饱和食盐水的化学方程式 。
(2)如果粗盐中SO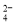 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO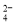 ,该钡试剂可以是 (选填A、B、C,多选扣分)
,该钡试剂可以是 (选填A、B、C,多选扣分)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)判断钡试剂已经过量的方法是 。
(4)为有效除去Ca2+、Mg2+、SO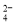 ,加入试剂的合理顺序为 (选填A,B,C多选扣分)
,加入试剂的合理顺序为 (选填A,B,C多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(5)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,
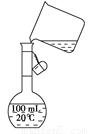
图中的错误是 。
关于该配制过程中,下列说法正确的是________。
A.应称取氯化钠晶体的质量为1.755 g
B.洗涤液不需要转移到容量瓶中
C.定容时,由于同学仰视,将导致所配溶液浓度偏低
D.摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com