
有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子,F的最高化合价和最低化合价的代数和为4.R是由B、F两元素形成的离子化合物,其中B+与F2﹣离子数之比为2:1.G位于周期表第6纵行且是六种元素中原子序数最大的.
请回答下列问题:
(1)D元素的电负性 F元素的电负性(填“>”、“<”或“=”).
(2)G的价电子排布图 .
(3)B形成的晶体堆积方式为 ,空间利用率为 区分晶体和非晶体最可靠的科学方法是对固体进行 实验.
(4)D﹣的最外层共有 种不同运动状态的电子,有 种能量不同的电子.F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是 ,F2D2是 分子(填“极性”或“非极性”).
(5)A与E形成的最简单化合物分子在水中溶解度很大的原因 .该分子是极性分子的原因 是 .
(6)如图所示是R形成的晶体的晶胞,设该晶体密度是ρ/g•cm﹣3.试计算R晶胞的体积是 (阿伏加德罗常数用NA表示,只写出计算式,不用计算)
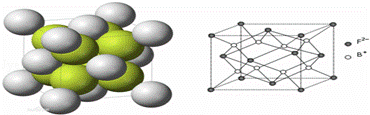
考点:
晶胞的计算;位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题;化学键与晶体结构.
分析:
A是宇宙中最丰富的元素,A为氢元素,D原子得一个电子填入3p轨道后,3p轨道全充满,则D为17号元素,氯元素;B和D的原子都有1个未成对电子,B+比D少一个电子层,则B为钠元素;E原子的2p轨道中有3个未成对电子,则E为氮元素;G位于周期表第6纵行且是六种元素中原子序数最大的在前四周期的,则G为铬元素;F的最高化合价和最低化合价的代数和为4,且原子序数小于铬元素,则F为硫元素;R是由B、F两元素形成的离子化合物,其中B+与F2﹣离子数之比为2:1;则R为Na2S,所以,A为氢,B为钠,D为氯,E为氮,F为硫,G为铬,据此答题.
解答:
解:(1)根据元素周期律可知氯的电负性大于硫,故答案为:>;
(2)铬为24号元素,价电子排布图为 ,故答案为:
,故答案为: ;
;
(3)晶体钠为体心立方堆积;空间利用率为68%;区分晶体和非晶体最可靠的科学方法是对固体进行X﹣射线衍射实验,故答案为:体心立方堆积;68%;X﹣射线衍射;
(4)根据核外电子排布规律可知,每个电子的运动状态都不相同,氯离子最外层有8个电子,所以就有8种不同运动状态的电子,最外层有两个能级,每个能级上电子能量是相同的,所以最外层有2种能量不同的电子,在S2Cl2中要使各原子都满足8电子稳定结构,则分子存在一个硫硫键和两硫氯键,则硫原子的价电子对数为4,所以硫原子按sp3方式杂化,硫原子周围有两对孤电子对,所以分子为极性分子,
故答案为:8;2;sp3;极性;
(5)A与E形成的最简单化合物为氨气,为极性分子,水也为极性分子,根据相似相容原理,另外氨气和水分间形成氢键氢键,部分氨气和水反应化学反应,都导致氨气在水中的溶解度较大;由于在氨分子中有孤电子对的存在,分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性,所以分子显极性,
故答案为:相似相容原理氨气和水均为极性分子,氨气和水分间形成氢键氢键,部分氨气和水反应化学反应;分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性;
(6)在每个晶胞中含有钠离子数为8,硫离子数为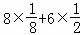 =4,根据V=
=4,根据V=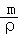 ,可得晶胞的体积为
,可得晶胞的体积为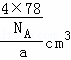 =
=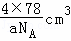 ,故答案为:
,故答案为: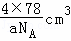 .
.
点评:
本题主要考查了原子核外电子排布、晶体的堆积方式、分子结构与性质、晶胞密度的有关计算等知识,难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中共存的是( )
|
| A. | K+、H+、SO42﹣、OH﹣ | B. | Na+、Ca2+、CO32﹣、NO3﹣ |
|
| C. | Na+、H+、Cl﹣、CO32﹣ | D. | Na+、Cu2+、Cl﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中,正确的是( )
|
| A. | 用湿润的红色石蕊试纸检验氨气 |
|
| B. | 在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl﹣ |
|
| C. | 将熟石灰和氯化铵混合加热,可以制备氨气 |
|
| D. | 加热试管中的氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和甘油 ③溴化钠和单质溴的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏、萃取 | B. | 萃取、蒸馏、分液、萃取 |
|
| C. | 分液、蒸馏、萃取、蒸馏 | D. | 蒸馏、萃取、分液、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为( )
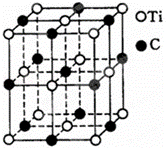
|
| A. | TiC | B. | Ti13C14 | C. | Ti4C7 | D. | Ti14C13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是( )
|
| A. | H2O、NH3•H2O、H3PO4、HF |
|
| B. | Cu(OH)2、CH3COOH、C2H5OH、CH3COONa |
|
| C. | H2SO3、Ba(OH)2、BaSO4 Fe |
|
| D. | H2SiO3、H2S、CO2 NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是( )
|
| A. | pH=3的硝酸跟pH=11的氢氧化钾溶液 |
|
| B. | pH=3的盐酸跟pH=11的氨水 |
|
| C. | pH=3的硫酸跟pH=11的氢氧化钠溶液 |
|
| D. | pH=3的醋酸跟pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是 ( )
A.人体内不含消化纤维素的消化酶,因此食物纤维对人体无用
B.碳酸氢钠可用于治疗胃酸过多和焙制糕点
C.油脂从化学成分上讲属于酯类化合物,是人类的主要营养物质之一
D.维生素有20多种,它们多数在人体内不能合成,需要从食物中摄取。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH )由大到小排列正确的是 ( )。
)由大到小排列正确的是 ( )。
A.②③④① B.②①③④
C.③②④① D.③②①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com