
| A、常温时,某溶液中由水电离出来的c(H+ )和c(OH- )的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO4 2- | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、油脂、淀粉和蛋白质在一定条件下都能发生水解反应 | ||
| D、SiO2和Al2O3都既能与酸反应,又能与碱反应,二者都属于两性氧化物 |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |


科目:高中化学 来源: 题型:
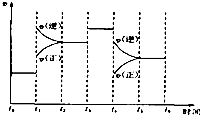 已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量的BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol?L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中少量的NaI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2可用于呼吸面具中氧气的来源 |
| B、Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
| C、Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治胃酸过多,制发酵粉等 |
| D、NaCl的性质稳定,可用作调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )
5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )| A、B点的横坐标a>10 |
| B、滴加前盐酸的物质的量浓度为0.1mol?L-1 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定大于C点的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钡的化学式为Ba2O2 |
| B、晶体中阴阳离子个数比为2:1 |
| C、1mol过氧化钡与足量水反应生成0.5mol氧气 |
| D、过氧化钠和过氧化钡都是强氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN- |
| B、含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I- |
| C、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、含有大量ClO-的溶液:OH-、K+、I-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,NA个甲烷和22.4L甲烷的质量相等 |
| B、1molNa2O2固体中含有离子总数为3NA个 |
| C、23 g金属钠变为钠离子时得到的电子数为NA |
| D、标况下,44.8L氦气所含的原子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com