
某饱和一元醛发生银镜反应时,生成21.6 g银,将等质量的醛完全燃烧,生成CO2的体积为13.44 L(标准状况),则 该醛是( )
该醛是( )
A.丙醛 B.丁醛 C.己醛 D.3甲基丁醛
科目:高中化学 来源: 题型:
关于“电解CuCl2溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是,“理论派”认为电解CuCl2溶液后溶液的pH升高;观点二是,“实验派”经过反复多次精确的实验测定,证明电解CuCl2溶液时pH的变化有如图所示的曲线关系。请回答下列问题:
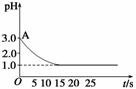
(1)电解前CuCl2溶液的pH处于A点的原因是(用离子方程式说明)_________
_______________________________________________________________。
(2)“理论派”所持观点的理论依据是_______________________________________
________________________________________________________________________。
(3)“实验派”的实验结论是_______________________________________________。
(4)你持何种观点?你所持观点的理由是____________________________________
____________________(从化学原理上加以简述)。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成P(一种抗氧剂)的路线如下:
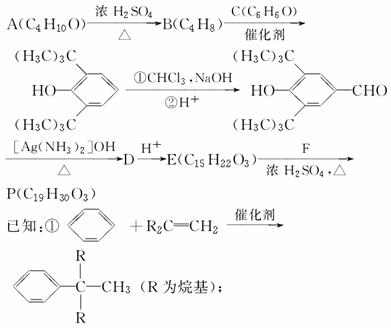
②A和F互为同分异构体,A分子中有三个甲基,F分子中只有一个甲基。
(1)A→B的反应类型为________。B经催化加氢生成G(C4H10),G的化学名称是________。
(2)A与浓HBr溶液一起共热生成H,H的结构简式为________。
(3)实验室中检验C可选择下列试剂中的________。
a.盐酸 B.FeCl3溶液
c.NaHCO3溶液 D.浓溴水
(4)P与足量NaOH溶液反应的化学反应方程式为_____________________________
________________________________________________________________________。(有机物用结构简式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示。

下列说法正确的是( )
A.该物质的分子式为C12H19N4O7
B.1 mol该物质与NaOH溶液反应,可以消耗4 mol NaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
以下食品化学知识的叙述不正确的是( )
A.食盐可作调味剂,也可作食品防腐剂
B.新鲜蔬菜做熟后,所含维生素C会有所损失
C.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质
D.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
查看答案和解析>>
科目:高中化学 来源: 题型:
双水杨酯可用于缓解包括头痛、牙痛、神经痛、关节痛及软组织炎症等各类疼痛,其结构如图所示。下列关于双水杨酯的性质描述正确的是( )
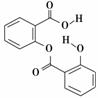
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1 mol该物质最多可与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO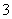 、Cl-、CO
、Cl-、CO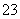 、Na+可以大量共存于pH=2的溶液中
、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(H2NCOONH4)是一种白色固体,易水解、受热易分解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0
H2NCOONH4(s) △H<0
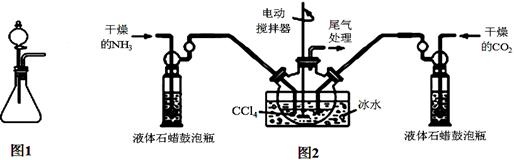
(注:四氯化碳与液体石蜡均为惰性介质)
(1)如用图1装置制取氨气,分液漏斗中的试剂名称是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
①发生器用冰水冷却的目的是 。
液体石蜡鼓泡瓶的作用是 。
 ②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 减压40 ℃以下烘干
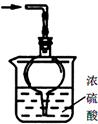
③尾气处理装置如右图所示。球形干燥管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有NH4HCO3的氨基甲酸铵样品15.64g,用足量石灰水充分处理后,使样品中所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为20 g。则样品中氨基甲酸铵的物质的量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中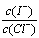 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0. | 0.773 | 0.780 | 0.784 |
① 根据上述实验结果,该反应的平衡常数K的计算式为:___________。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com