
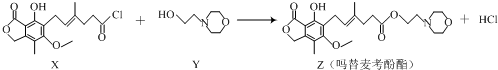
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
分析 A.连接四个不同的原子或原子团的碳原子为手性碳原子;
B.根据结构简式确定分子式;
C.Z中酚羟基、酯基水解生成的羧基都能和NaOH反应;
D.X和Z中都含有碳碳双键,都与溴发生加成反应.
解答 解:A.连接四个不同的原子或原子团的碳原子为手性碳原子,根据结构简式知,该分子中没有手性碳原子,故A错误;
B.根据结构简式确定分子式为C6H13NO2,故B错误;
C.Z中酚羟基、酯基水解生成的羧基都能和NaOH反应,则1mol化合物Z可以与3mol NaOH反应,故C正确;
D.X和Z中都含有碳碳双键,都与溴发生加成反应,所以用溴水无法鉴别X和Z,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查学生分析判断能力,侧重考查烯烃、酯和酚的性质,注意Z中水解生成的酚羟基能与NaOH反应,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 气态氢化物的热稳定性:Y<Z | |
| C. | 简单阴离子的还原性:Y>X | |
| D. | 最高价氧化物对应的水化物的酸性:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
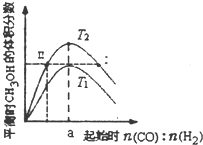 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 由图象可推知,反应温度T2>T1 | |
| B. | 同一温度,增大压强,平衡右移,平衡常数K增大 | |
| C. | 同一温度,当a=0.5时,CO转化率最高 | |
| D. | 对于状态I和II,若再向体系中充入He,重新达到平衡后,二者的平衡体系中CH3OH的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝熔点很高,可用于制造耐火坩埚 | |
| B. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| C. | 氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多 | |
| D. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O; ③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu; ④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于净水 | |
| B. | 氨可用于生产铵盐、纯碱 | |
| C. | 铝热反应可用于冶炼某些金属 | |
| D. | 核磁共振氢谱可用于测量某些有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:实验题
实验室要配制100mL1.0mol·L-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl 固体________g 。
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是_________。(填序号)
A.锥形瓶
B.200mL容量瓶
C.烧杯
D.胶头滴管
E.药匙
F.托盘天平
(3)下列操作中,容量瓶所不具备的功能有_______(填序号)。
A.配制一定体积准确溶度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取任意体积的液体
容量瓶上除有刻度线外还应标有_________、__________、且容量瓶在使用前必须__________。
(4)若实验室需要配制0.5mol/L硫酸溶液450mL,则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_______mL规格的量筒最好。
(5)下列四项错误操作会导致所得溶液浓度偏高的是_______(填序号)。
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com