
| A. | 金属元素A的单质不能把金属元素B从它的盐溶液中置换出来,一定可以说明金属性:A<B | |
| B. | 根据反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可说明C的非金属性比Si强 | |
| C. | 周期表中第n周期第n主族的元素均为金属 | |
| D. | 按照元素周期表的排布规律,非金属元素最多为23种 |
分析 A、钠与硫酸铜溶液反应不能置换出铜,但金属钠比铜活泼;
B、元素的非金属性是指元素的原子得电子的能力,当元素得电子的时候相当于化合价降级(例如由正1价到0),也就是被还原;
C、氢是第一周期第ⅠA元素;
D、按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1.
解答 解:A、钠与硫酸铜溶液反应不能置换出铜,但金属钠比铜活泼,所以不可以说明A的金属性一定小于B,故A错误;
B、元素的非金属性是指元素的原子得电子的能力,当元素得电子的时候相当于化合价降级(例如由正1价到0),也就是被还原,碳是失电子而硅得电子,所以不能说明C的非金属性比Si强,故B错误;
C、氢是第一周期第ⅠA元素,但是非金属元素,故C错误;
D.按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1,共23种,故D正确.
故选D.
点评 本题综合考查元素周期表、元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOH电离程度变大 | B. | 溶液pH减小 | ||
| C. | 溶液的导电能力减弱 | D. | 溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
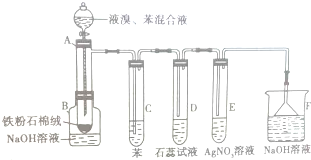 如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:
如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置和方法测定一定时间内生成H2的反应速率 | |
| B. | 用图2装置和方法进行C02喷泉实验 | |
| C. | 用图3装装置和方法除去氯气中的氯化氢 | |
| D. | 用图4装置和方法比较Na2C03与NaHC03热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.28 L | B. | 0.56 L | C. | 0.14 L | D. | 11.2 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com