
分析 原子的左下角为质子数,核外电子数=质子数,根据能量最低原则、泡利不相容原理和洪特规则综合考虑,写出核外电子排布式.
解答 解:(1)Cl所含质子数为17,原子核外电子数为17,根据能量最低原则、泡利不相容原理和洪特规则核外电子排布式为1s22s22p63s23p5,
故答案为:1s22s22p63s23p5;
(2)Cr所含质子数为24,原子核外电子数为24,3d能级上的原子轨道处于半满时,能量较低,因此核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(3)Se所含质子数为34,原子核外电子数为34,根据能量最低原则、泡利不相容原理和洪特规则写出为[Ar]3d104s24p4,
故答案为:[Ar]3d104s24p4;
(4)Cu所含质子数为29,原子核外电子数为29,3d能级上的原子轨道处于全满时,能量较低,因此核外电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d104s1.
点评 本题考查了原子核外电子排布式的书写,Cr、Cu的电子排布书写为解答的易错点,注意半满为稳定状态,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,同体积的气体A、B质量比m:n | |
| B. | 25℃时,1Kg气体A与1Kg气体B的分子数之比为n:m | |
| C. | 同温同压下,气体A与气体B的密度之比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
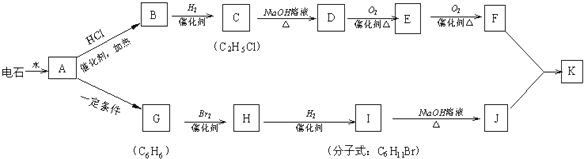
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品添加剂对人体的健康均无害,所以不用严格控制用量 | |
| B. | 棉、麻、丝、毛的主要成分都是纤维素 | |
| C. | 光纤的主要成分是二氧化硅 | |
| D. | 农业施肥所用的碳铵和尿素均属于无机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com