

分析 (1)金属镁和铝容易被氧气氧化,进入氩气可以防止镁铝被氧化;
(2)根据图2加入136.7mL氢氧化钠溶液时恰好生成0.29mol氢氧化铝和氢氧化铝沉淀,加入156.7mL氢氧化钠溶液时,沉淀被溶解的为氢氧化铝,据此可以计算出氢氧化铝、氢氧化铝的物质的量,根据质量守恒可知镁铝的物质的量之比;
(3)根据氢氧化铝与氢氧化钠反应的方程式及氢氧化铝的物质的量、氢氧化钠的体积计算出氢氧化钠的浓度;
(4)释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(5)镁不与氢氧化钠溶液反应,铝能够与氢氧化钠溶液反应,所以负极为铝,正极为镁,负极铝失去电子与氢氧根离子反应生成偏铝酸根离子,据此写出电极反应;
(6)根据图1中反应产物判断原电池电极,然后判断电解池的阴、阳极.
解答 解:(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是防止镁铝被空气中的氧气氧化,
故答案为:防止镁铝被空气氧化;
(2)氢氧化镁和氢氧化铝总物质的量为:0.29mol,加入过量氢氧化钠溶液后,剩余的0.17mol沉淀为氢氧化镁,则氢氧化铝沉淀的物质的量为0.12mol,根据质量守恒定律可知,原合金中镁和铝的物质的量之比为:0.17mol:0.12mol=17:2,所以该镁铝合金(MgxAly)的化学式为:Mg17Al12,
故答案为:Mg17Al12;
(3)溶解0.12mol氢氧化铝消耗氢氧化钠的体积为:(156.7-136.7)mL=20mL,根据反应方程式Al(OH)3+OH-=AlO2-+2H2O可知,氢氧化钠的物质的量浓度为:$\frac{0.12mol}{0.02L}$=6mol•L-1,
故答案为:6mol•L-1;
(4)1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,1molMg17Al12完全反应生成氢气的物质的量分别为地17mol、18mol,则生成氢气一共(17+17+18)mol=52mol,
故答案为:52mol;
(5)由于镁不与氢氧化钠溶液反应,所以负极为铝,电解质为氢氧化钠溶液的负极反应为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
(6)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,所以b为正极,c为负极,M连接的为电源正极,则M为阳极,Al在阳极放电;
故答案为:Al.
点评 本题考查了有关混合物的简单计算、原电池、电解池工作原理等知识,题目难度中等,试题题量稍大,掌握掌握原电池、电解池工作原理,明确混合物组成的计算方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及其含碳化合物在人们的生产生活中应用广泛.
碳及其含碳化合物在人们的生产生活中应用广泛.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO2 | H2 | H2 | C2H5OH | |||
| 1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
| 2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
| 3 | 900 | 4 | 8.8 | C | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
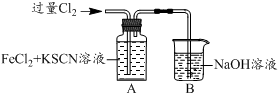 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③⑥ | C. | ①②④ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肉类富含蛋白质,属于碱性食物 | |
| B. | 碳酸氢钠可用于治疗胃酸过多 | |
| C. | 碘是人体必需的微量元素之一 | |
| D. | 食用富含维生素C的水果有益于身体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Na2O | C. | NaOH | D. | Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com