
【题目】(13分)【[化学—有机化学基础】没食子酸丙酯简称PG,结构简式为 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
(1)PG的分子式为 ,请写出PG分子中所含官能团的名称 ,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是 。
PG可发生如下转化:
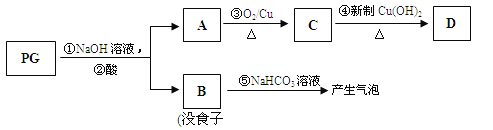
(2)A的结构简式为 ,1mol没食子酸最多可与 mol H2 加成。
(3)上图的有关变化中,属于氧化反应的有(填序号) 。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号) 。
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为: 。
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式: 。
i.含有苯环,且苯环上的一溴代物只有一种;
ii.既能发生银镜反应,又能发生水解反应。
【答案】(13分)
(1)C10H12O5,羟基、酯基,4mol(各1分)
(2)CH3CH2CH2OH(1分); 3(1分);
(3)③④ (2分。对一个给1分,错一个扣1分。)
(4)c(1分)
(5)CH3CH2CHO + 2Cu(OH)2 ![]() CH3CH2COOH + Cu2O↓+ 2H2O(2分,不配平的给1分)
CH3CH2COOH + Cu2O↓+ 2H2O(2分,不配平的给1分)
(6)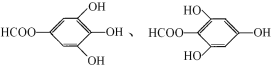 (各1分)
(各1分)
【解析】
试题分析:(1)根据PG的结构简式可知,其分子式为C10H12O5,由PG结构简式可知,PG分子中含有酯基与羟基,酯基(羧酸与醇形成)与酚羟基都与氢氧化钠按1:1反应,1molPG含有3mol酚羟基,1mol酯基(羧酸与醇形成),故1moPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量为4mol;
(2)PG在氢氧化钠水溶液条件下发生水解反应,并酸化得到没食子酸与A,故A为CH3CH2CH2OH,没食子酸的结构简式为![]() ,没食子酸含有苯环,1mol没食子酸与3mol氢气发生加成反应;
,没食子酸含有苯环,1mol没食子酸与3mol氢气发生加成反应;
(3)反应③是CH3CH2CH2OH氧化生成CH3CH2CHO,反应④是CH3CH2CHO氧化生成CH3CH2COOH,反应①属于水解反应,反应②⑤是复分解反应;
(4)没食子酸丙酯简微溶于油脂,含有酚羟基,易被氧化,可以防止食用油被氧化;
(5)由转换关系可知,C为CH3CH2CHO,D为CH3CH2COOH,反应④是CH3CH2CHO氧化生成CH3CH2COOH,反应方程式为:CH3CH2CHO+2Cu(OH)2![]() CH3 CH2COOH+Cu2O↓+2H2O;
CH3 CH2COOH+Cu2O↓+2H2O;
(6)含有苯环,且苯环上的一溴代物只有一种,说明苯环上只有1种H原子,既能发生银镜反应,又能发生水解反应,结合没食子酸的结构,说明为甲酸酚酯,符合条件的同分异构体有: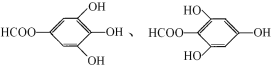 。
。


科目:高中化学 来源: 题型:
【题目】为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下实验流程:
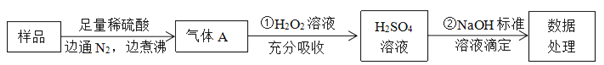
(1)通入N2的目的是_______________________
(2)第①步反应的离子方程式是______________________
(3)滴定实验若选择酚酞作指示剂,则滴定终点的标志是________滴定过程中以下操作使测定结果偏高的是________(填编号)
a. 洗净的滴定管未用标准液润洗
b. 滴定中向锥形瓶内壁加少量水
c. 滴定前滴定管正常,滴定后尖嘴部分有气泡
d. 锥形瓶用待测液洗涤2-3次
(4)若实验室欲制取SO2可选用试剂__________(填编号)
a. 铜和浓硫酸 b. 硫和氧气
c. 亚硫酸钠和浓度70%的硫酸 d. 亚硫酸钙和硝酸
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀,此时溶液中一定有的溶质是_________。请用电离平衡解释上述实验现象:_________________
(6)H2O2是一种绿色氧化剂。某NH4Cl样品中含少量Fe2+、SO42-,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,即得到工业氯化铵。
滤渣的主要成分是_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
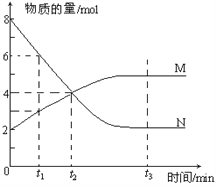
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

(1)定性分析:
①如图甲可通过观察_____________________________________,定性比较得出结论。
②有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________,
③若H2O2在二氧化锰催化作用下发生反应,曾检测出有物质MnO3出现,写出整个反应过程的两个化学方程式:___________________________,________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )
A. 盐类的水解过程破坏了纯水的电离平衡B. 盐类的水解是酸碱中和反应的逆反应
C. 溶液中c(Na+)是c(S2-)的两倍D. 盐类水解后的溶液不一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A. 1:1 B. 2:3 C. 3:2 D. 1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
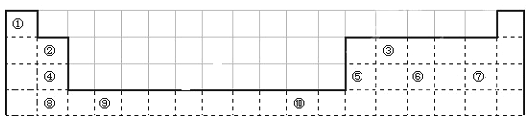
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)⑥和⑦形成的分子中各个原子均满足8电子稳定结构,其立体构型为________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子和⑦形成的分子,中心原子上的价层电子对数为_______。
(4)元素⑦和⑧形成的化合物的电子式为__________。
(5)元素⑩的基态+2价离子的电子排布式是__________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com