

| ||
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| x | ||
7-x+11-
|
| 1400 |
| 207 |
| x |
| 7 |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| x | ||
7-x+11-
|
| 1400 |
| 207 |
| x |
| 7 |
| 162.9KJ×80g/mol |
| 100g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| b |
| t |
| b |
| t |

查看答案和解析>>
科目:高中化学 来源: 题型:
 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.V2O5是接触法制硫酸的催化剂.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.V2O5是接触法制硫酸的催化剂.| b |
| t |
| b |
| t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| b |
| t |
| b |
| t |

查看答案和解析>>
科目:高中化学 来源: 题型:
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下,![]() 与空气反映t min后,
与空气反映t min后,![]() 和
和![]() 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则![]() 起始物质的量浓度为 mol/L ;生成
起始物质的量浓度为 mol/L ;生成![]() 的化学反应速率为 mol/(L·min) .
的化学反应速率为 mol/(L·min) .
②工业制硫酸,尾气![]() 用_______吸收.
用_______吸收.
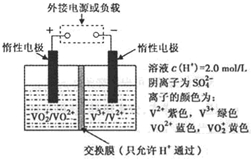
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.

①当左槽溶液逐渐由黄变蓝,其电极反应式为 .
②充电过程中,右槽溶液颜色逐渐由 色变为 色.
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01![]() 1023个,左槽溶液中n(H+)的变化量为 .
1023个,左槽溶液中n(H+)的变化量为 .
查看答案和解析>>
科目:高中化学 来源:2010年高考试题--化学(重庆卷)解析版 题型:实验题
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下, 与空气反映t min后,
与空气反映t min后, 和
和 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则 起始物质的量浓度为
mol/L ;生成
起始物质的量浓度为
mol/L ;生成 的化学反应速率为
mol/(L·min) .
的化学反应速率为
mol/(L·min) .
②工业制硫酸,尾气 用_______吸收.
用_______吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.

①当左槽溶液逐渐由黄变蓝,其电极反应式为 .
②充电过程中,右槽溶液颜色逐渐由 色变为 色.
③放电过程中氢离子的作用是
和 ;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为
.
1023个,左槽溶液中n(H+)的变化量为
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com