

���� ��1��ͼ1Ϊԭ��ط�Ӧ��FeΪ������������Fe-2e-=Fe2+��ʯīΪ����������Cu2++2e-=Cu��
��2��NH4Cl����Һ��ˮ�������ԣ�������Һ�У������������ӵõ��ӣ������ӱ���������ΪFeO42-��
��3���������Ż�����ͭ������ʯī������n�ͣ���װ��Ϊ����������ʴ����Ϊ����װ�ã�
��� �⣺��1��ͼ1Ϊԭ��ط�Ӧ��FeΪ������������Fe-2e-=Fe2-��ʯīΪ����������Cu2++2e-=Cu���ܷ�ӦʽΪFe+Cu2+�TFe2++Cu��һ��ʱ������缫�������12g��
��Fe+Cu2+�TFe2++Cu �����������m ת�Ƶ���
56g 64g 56g+64g=120g 2mol
12g n
n=0.2mol��
�ʴ�Ϊ��Fe+Cu2+�TFe2++Cu��0.2��
��2�������������䣬����CuCl2��Һ��ΪNH4Cl��Һ��NH4Cl����Һ��ˮ�������ԣ�������Һ�У������������ӵõ��ӣ���ʯī�缫�����ĵ缫��ӦΪ2H++2e-=H2���������ӱ���������ΪFeO42-���䷴Ӧ�����ӷ���ʽΪ��2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+��
�ʴ�Ϊ��2H++2e-=H2�������ԣ�2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+��
��3���������Ż�����ͭ������ʯī������n�ͣ���װ��Ϊ����������ʴ����Ϊ������ͭΪ�������������� O2+2H2O+4e-�T4OH-���ʼ��ԣ��μӷ�̪����Һ��죬����װ����ͭ������ʯīΪ����������������ʯīΪ������
�ʴ�Ϊ����Һ��죻 O2+2H2O+4e-�T4OH-������
���� �����ۺϿ���ԭ��غ͵���֪ʶ�������ڵ绯ѧ֪ʶ���ۺ����õĿ��飬��Ŀ�Ѷ��еȣ�ע����յ缫��Ӧ����ʽ����д�͵����غ��ڼ����е�Ӧ��Ϊ������Ĺؼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
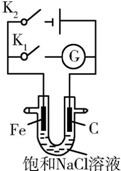
| A�� | K1�պϣ������Ϸ����ķ�ӦΪ2H++2e-�TH2�� | |
| B�� | K1�պϣ�ʯī����Χ��Һ��pH���� | |
| C�� | K2�պϣ��������ᱻ��ʴ�������������������������� | |
| D�� | K2�պϣ���·��ͨ��0.002NA������ʱ������������0.002 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L H2O���еķ�����Ϊ NA | |
| B�� | 28g N2��N4��ɵĻ�������к��е�ԭ����Ϊ2 NA | |
| C�� | 1 mol•L-1A1Cl3��Һ�к��е�Cl-��ĿΪ3 NA | |
| D�� | 2.3 g Na������ˮ��Ӧ��ת�Ƶĵ�����ĿΪ0.2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 0.1mol•L-1��NH4��2Fe��SO4��2��Һ�У�c��NH4+��+c��NH3•H2O��+c��Fe2+��=0.3mol•L-1 | |
| B�� | �����£�pH=6��NaHSO3��Һ�У�c��SO32-��-c��H2SO3��=9.9��10-7mol•L-1 | |
| C�� | NH4HSO3��Һ�еμ�NaOH����Һǡ�ó����ԣ�c��Na+����c��SO42-��=c��NH4+����c��OH-��=c��H+�� | |
| D�� | ��Ũ�ȡ��������Na2CO3��NaHCO3��ϣ�$\frac{c��HC{{O}_{3}}^{-}��}{c��{H}_{2}C{O}_{3}��}$��$\frac{c��C{{O}_{3}}^{2-}��}{c��HC{{O}_{3}}^{-}��}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�����ĵ�Zn������Ϊ97.5 g | B�� | ����A��SO2��H2�������Ϊ1��4 | ||
| C�� | ��Ӧ�б���ԭ��Ԫ��ֻ��һ�� | D�� | ��Ӧ�й�ת�Ƶ���3 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
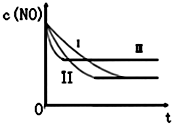 ����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C��NO��10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C��CO��10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
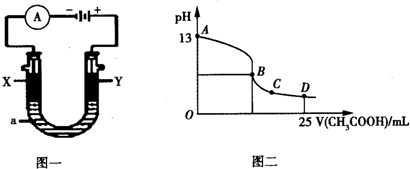
| ʵ�� ��� | T/��C | NO��ʼŨ ��/10-3mol•L-1 | CO��ʼŨ ��/10-3mol•L-1 | �����ı� �����/m2•g-1 |
| �� | 350 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 82 |
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
| H2O | CO | CO | H2 | |||
| �� | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| �� | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| �� | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�к��зḻ�ĵ�Ԫ�أ��ʵⱻ��Ϊ������Ԫ�ء� | |
| B�� | �廯����һ����Ҫ�ĸй���ϣ�Ҳ�������˹����� | |
| C�� | ����ʢ�������ļ���ƿ��ȼ�գ�����ʲ�ɫ������ΪNaCl������ʢ�������ļ���ƿ��ȼ�գ�������ػ�ɫ������ΪFeCl3 | |
| D�� | ��ҵ�������豸��������¯�������м���ʯ��ʯ�������dz���ʯ��SiO2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
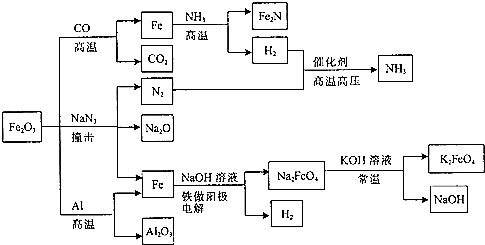
| A�� | Fe2O3��Al�ķ�Ӧ�������ȷ�Ӧ | |
| B�� | Fe2O3��NaN3��Ӧ��ÿ����1molFe2O3����9molN2 | |
| C�� | Fe2O3��CO�ķ�Ӧ�����û���Ӧ | |
| D�� | ������K2FeO4��ˮ�е��ܽ�ȱ�Na2FeO4�Ĵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com