
| A. | 混合气体的压强 | B. | 气体的总体积 | ||
| C. | 混合气体的相对分子质量 | D. | 气体的总物质的量 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边气体的计量数相等,所以容器的压强始终不变,所以不能作为平衡状态的标志,故A错误;
B、反应前后气体物质的量不变,气体体积始终不变,不能说明反应达到平衡状态,故B错误;
C、反应前后气体质量变化,气体物质的量不变,混合气体的相对分子质量不变说明反应达到平衡状态,故C正确;
D、两边气体的计量数相等,气体的总物质的量一直不变,不能说明反应达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,题目难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
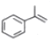 (异丙烯苯)$→_{一定条件}^{+H_{2}}$
(异丙烯苯)$→_{一定条件}^{+H_{2}}$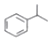 (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 反应属于加成反应 | B. | 异丙苯的一氯代物共有6种 | ||
| C. | 可用溴水鉴别异丙烯苯和异丙苯 | D. | 异丙苯是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁醇的结构简式可写作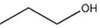 | |
| B. | 氨基酸合成多肽链属于加聚反应 | |
| C. | 分子式为C4H8O2,既含有羟基又含有醛基的同分异构体有5种 | |
| D. | 糖、油脂、蛋白质等这些人体必需的营养物质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| C. | 充电时,蓄电池的负极应与外接电源正极相连 | |
| D. | 放电时负极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
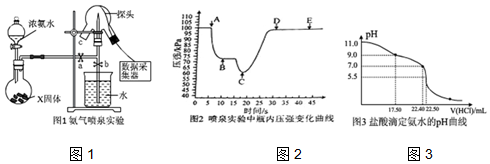
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
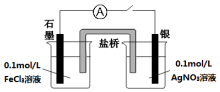 甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:
甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com