
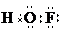 ,则HFO的结构式为
,则HFO的结构式为 (在HFO的结构式中标出各元素的化合价).
(在HFO的结构式中标出各元素的化合价).分析 ①依据次氯酸结构式H-O-Cl推断HFO的结构,并写出电子式;
②依据非金属性F>O>Cl判断解答;
③依据次氟酸能与水反应生成两种物质,其中有一种物质为HF结合原子个数守恒规律可知另一种产物为过氧化氢,据此书写方程式.
解答 解:①次氯酸结构-式HO-Cl,可知HFO的结构式为H-O-F,电子式为: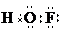
故答案为: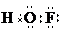

②依据非金属性F>O>Cl,可知次氯酸卤素显正价,而次氟酸中的氟元素显负价,所以把HFO称着“次氟酸”;
③依据次氟酸能与水反应生成两种物质,其中有一种物质为HF结合原子个数守恒规律可知另一种产物为过氧化氢,方程式:HFO+H2O=H2O2+HF;
故答案为:HFO+H2O=H2O2+HF.
点评 本题考查了物质的结构及性质,明确次氯酸结构结合非金属性F>O>Cl即可解答,题目难度中等,注意对已有知识的迁移应用.


科目:高中化学 来源: 题型:选择题
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将NaOH溶液逐滴加入饱和FeCl3溶液制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
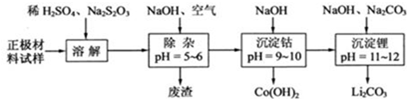
| A. | 在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生的反应8LiCoO2+Na2S2O3+11H2SO4═4 Li2SO4+8CoSO4+Na2SO4+11H2O | |
| B. | 调整pH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去 | |
| C. | Co(OH)2沉淀完全后,溶液中不存在Co2+ | |
| D. | Li与Mg在周期表中处于对角线位置,性质有相似性,因此单质Li可用电解法回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
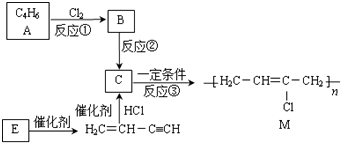
 ,该反应类型属于消去反应.
,该反应类型属于消去反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{71ω}{161(ω+α)}$×100% | B. | $\frac{71ω}{161(ω+18α)}$×100% | ||
| C. | $\frac{ω}{ω+18α}$×100% | D. | $\frac{ω}{ω+36α}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向 NaAlO2溶液中通入过量二氧化碳:AlO2-+CO2+2H2O═Al(OH)3+HCO3- | |
| C. | 在强碱溶液中次氯酸钠与氢氧化铁反应生成 Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+4H+ | |
| D. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品干燥剂 | |
| B. | 二氧化硅可制成石英坩埚 | |
| C. | 单质硅可用于制光导纤维 | |
| D. | 硅酸钠溶液浸泡木材可起到防火作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com