
 如表中的数据是破坏1mol物质的化学键所消耗的能量:
如表中的数据是破坏1mol物质的化学键所消耗的能量:| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
分析 (1)根据能量越高键能越小越不稳定判断;
(2)①化学键断裂要吸收能量,形成化学键要放出能量,则由表中数据判断;
②根据Cl-Cl键的键能比H-H键的键能小,更易断裂,从而引发反应判断;
③在反应中H2(g)+Cl2(g)=2HCl(g),反应热等于反应物的总键能减生成物的总键能,以此解答该题.
解答 解:(1)因为能量越高键能越小越不稳定,又HCl、HBr和HI的键能越来越小,所以HI最不稳定,故选:C;
(2)①化学键断裂要吸收能量,形成化学键要放出能量,则由表中数据可知△H1=+243 kJ•mol-1,△H2=+436 kJ•mol-1,△H3=-431 kJ•mol-1,
故答案为:+243;+436;-431;
②引发该反应的第一步是上图①~③中分子转化为原子的第①步,因Cl-Cl键的键能比H-H键的键能小,更易断裂,从而引发反应,
故答案为:①;Cl-Cl键的键能比H-H键的键能小,更易断裂,从而引发反应;
③在反应中H2(g)+Cl2(g)=2HCl(g),反应热等于反应物的总键能减生成物的总键能,则△H=(436+243-2×431)kJ/mol=-183 kJ•mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,该题易错点为(2),注意把握反应的特点以及反应热的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物都是酸 | |
| B. | 胶体区别于其他分散系的本质特征是能产生丁达尔效应 | |
| C. | 冰水混合物是电解质 | |
| D. | 强电解质溶液的导电能力一定强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .画出G离子的结构示意图
.画出G离子的结构示意图
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
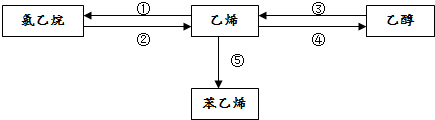
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加压强 | B. | 升高温度 | C. | 不断搅拌 | D. | 升温减压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 常温常压下,1mol氦气中含有的核外电子数为2NA | |
| D. | ag某气体含分子数为b,cg该气体在标况下的体积为L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产 物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 氧化性由强到弱顺序为MnO4->C12>Fe3+>Br2 | |
| B. | 第①组反应的氧化产物为O2 | |
| C. | 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 1L 0.1 mol•L-1 NaHCO3溶液中含有0.1NA个HCO3- | |
| C. | 0.1 mo1铁粉在0.1 mol氯气中充分燃烧,失去的电子数目为0.3NA | |
| D. | 1 mol苯含有6 NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用Cl2和NaClO3制备ClO2,其中n (氧化剂):n (还原剂)=1:2 | |
| B. | ClO2在强碱性环境中使用失效:2ClO2+2OH-═ClO3-+ClO2-+H2O | |
| C. | ClO2处理饮用水时残留的ClO2-,可用FeSO4来除去:ClO2-+2Fe2++4H+═2Fe3++Cl-+2H2O | |
| D. | 等物质的量的ClO2杀菌效果比Cl2、HClO强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com