
| 1 |
| 4 |
| 1 |
| 4 |
| 3mol |
| 6 |


科目:高中化学 来源: 题型:
| A、重金属离子对人体有剧毒,可采用沉淀反应除去之 |
| B、化肥中含有植物营养素,可大量使用以改善水环境 |
| C、轧钢厂排出的含盐酸的废水,可用熟石灰中和处理 |
| D、天然水中的细小悬浮颗粒,可用明矾等混凝剂净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主 食 | 米 饭 |
| 副 食 | 红烧鱼 |
| 饮 品 | 豆 浆 |
| 你的补充 | ? |
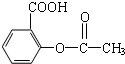 ,则其分子式为
,则其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、容器内的总压强为原来的2倍 |
| B、NH3的浓度为原来的2倍 |
| C、H2的转化率为原来的2倍 |
| D、气体的密度为原来的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com