
| A. | 稀硫酸 | B. | 稀硝酸 | C. | NaOH溶液 | D. | 硫酸铜溶液 |
分析 A、稀硫酸无论铝在浓硝酸中是钝化还是没有反应都有无色气体一氧化氮产生;
B、稀硝酸无论铝在浓硝酸中是钝化还是没有反应都有无色气体一氧化氮产生;
C、氢氧化钠溶液无论铝在浓硝酸中是钝化还是没有反应都有无色气体氢气产生;
D、如果是钝化加硫酸铜溶液无明显现象,但如果不反应加硫酸铜有红色固体产生.
解答 解:A、稀硫酸无论铝在浓硝酸中是钝化还是没有反应都有无色气体一氧化氮产生,两者现象相同,无法区别,故A错误;
B、稀硝酸无论铝在浓硝酸中是钝化还是没有反应都有无色气体一氧化氮产生,两者现象相同,无法区别,故B错误;
C、氢氧化钠溶液无论铝在浓硝酸中是钝化还是没有反应都有无色气体氢气产生,两者现象相同,无法区别,故C错误;
D、如果是钝化加硫酸铜溶液无明显现象,但如果不反应加硫酸铜有红色固体产生,两者现象不同,符合条件,故D正确;
故选D.
点评 本题考查学生金属铝的有关知识,比较基础,旨在考查学生对基础知识的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
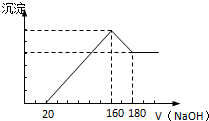 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
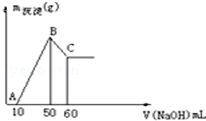 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中有铜、铁均有 | B. | 烧杯中Fe3+、Cu2+、Fe2+均有 | ||
| C. | 烧杯中Cu和Cu2+均有 | D. | 烧杯中Cu2+、Fe2+、Cu和Fe均有 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
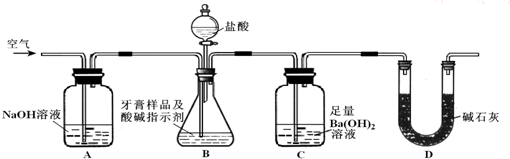
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有可逆反应A(g)+B(g)?xC(g)+D(g),某温度时,在固定容积为2L的密闭容器内充入一定量的A、B,并保持温度不变.A、B、C、D物质的量随时间的变化如图所示:
有可逆反应A(g)+B(g)?xC(g)+D(g),某温度时,在固定容积为2L的密闭容器内充入一定量的A、B,并保持温度不变.A、B、C、D物质的量随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12=2Fe3++Br2+4C1- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com