
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
分析 将所给化学计量数带入方程式有:
A、2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-,氯气足量时可以发生;
B、0Fe2++2Br-+Cl2→0Fe3++Br2+2Cl-,氧化性Br2>Fe3+,不可能;
C、2Fe2++0Br-+Cl2→2Fe3++0Br2+2Cl-,氯气不足时,可以发生;
D、2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,氯气不足,把亚铁离子氧化成三价铁离子后,再部分氧化溴离子.
解答 解:将所给化学计量数带入方程式,据氧化性Br2>Fe3+可知,通入少量氯气时,首先氧化亚铁离子分析,
A、氯气过量,Br-、Fe2+都完全被完全氧化,反应方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故A正确;
B、氧化性Br2>Fe3+,不可能存在Fe2+、Br2共存,故B错误;
C、加入的氯气的物质的量与铁的物质的量1:2时,发生反应 2Fe2+-+Cl2═2Fe3++2Cl-,故C正确;
D、当加入的氯气把Fe2+完全氧化成Fe3+,还有部分剩余时,可以发生反应2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,故D正确;
故选B.
点评 本题考查氧化还原反应中的强弱规律,难度稍大,需要耐心、认真分析.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
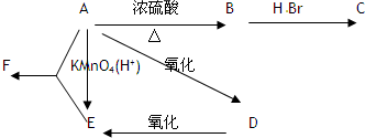
 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
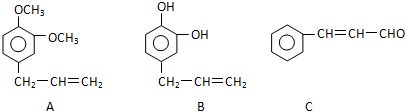
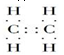 ,B的结构简式
,B的结构简式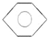 或
或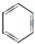 .
. ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Na+NO3- Cl- | B. | K+ Na+Cl- NO3- | ||
| C. | K+ Na+ Cl-AlO2- | D. | K+ NH4+ SO42-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
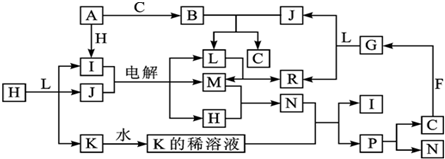
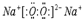 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 固体时能导电的晶体一定为金属晶体 | |
| B. | 电负性差值小于1.7的A、B两种元素,组成的化合物也可能为离子化合物 | |
| C. | 某晶体难溶于水、熔点高、固态不导电,熔化时导电,可判断该晶体为离子晶体 | |
| D. | 由原子构成的晶体均具有熔沸点高、硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +5H2$\stackrel{一定条件下}{→}$
+5H2$\stackrel{一定条件下}{→}$ .
. .
.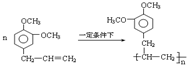 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com