
“碘钟”实验中,3I-+S2O ===I
===I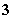 +2SO
+2SO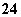 的反应速率可以用I
的反应速率可以用I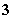 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| [I-]/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| [S2O | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1) 该实验的目的是______________________________________________________
________________________________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
________________________________________________________________________
________________________________________________________________________。
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
氮元素可以形成多种化合物.回答以下问题:
(1)N≡N的键能为942kJ•mol﹣1,N﹣N单键的键能为247kJ•mol﹣1.计算说明N2中的 键更稳定(填“π”或“σ”).
(2)N2与O22+互为等电子体,O22+的电子式可表示为 .
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被﹣NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是 ;N2H4分子结构式为 .
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=﹣1038.7kJ•mol﹣1
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还原法。由于三氯氢硅氢还原法具有一定优点,被广泛应用。其简化的工艺流程如下图所示:
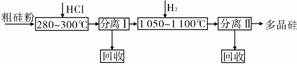
(1)由纯SiHCl3制备高纯硅的化学方程式为________________。该生产工艺中可以循环使用的物质是____________________(写出两种)。
(2)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法,工业上广泛采用的合成硅烷的方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,反应的化学方程式是______________________(不需注明反应条件,下同);整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为_____________ _____;整个系统必须与空气隔绝,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量的ClO2,这是因为( )
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出的ClO2使反应生成物的浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2。对此反应的下列叙述中正确的是( )
A.使用催化剂能加快反应的速率
B.使一种反应物过量能提高反应的速率
C.改变压强对反应速率没有影响
D.降低温度能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2发生反应:N2+3H2
 2NH3,2 min时,测得剩余N2为1 mol,对于这个化学反应的反应速率表示不正确的是( )
2NH3,2 min时,测得剩余N2为1 mol,对于这个化学反应的反应速率表示不正确的是( )
A.v(N2)=0.25 mol·L-1·min-1
B.v(H2)=0.75 mol·L-1·min-1
C.v(NH3)=0.5 mol·L-1·min-1
D.v(N2)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y===2Z,如图所示是该反应中X的物质的量随时间变化的曲线。
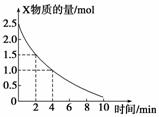
(1)分别求出2 min内和4 min内的平均速率。
(2)从(1)中数据可以得出什么结论?
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是(双选)( )
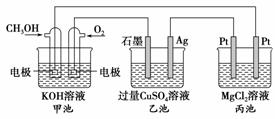
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO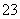 +8H+
+8H+
C.反应一段时间后,向乙池中加入一定量CuO或CuCO3固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O 的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.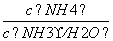 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH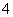 )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com