
| A. | H2O与BeCl2为角形(V形) | B. | CS2与SO2为直线形 | ||
| C. | BF3与PCl3为三角锥形 | D. | SO3与CO${\;}_{3}^{2-}$为平面三角形 |
分析 根据价层电子对互斥模型(VSEPR模型)确定微粒的空间构型,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断立体结构.
解答 解:A.水分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,BeCl2 中Be原子的价层电子对个数=2+$\frac{1}{2}$×(2-2×1)=2,不含孤电子对,则分子空间构型是直线型,故A错误;
B.CS2分子中每个S原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2且不含孤电子对,所以为直线形结构,SO2分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3且含有1个孤电子对,所以为V形结构,故B错误;
C.BF3分子中B原子的价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3且不含有孤电子对,所以其空间构型为平面三角形,PCl3中,价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子形状为三角锥形,故C错误;
D.SO3中,价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,含孤电子对数为0,杂化轨道数3,硫原子采用sp2杂化,分子形状为平面三角形;CO32-中碳原子价层电子对个数=3+$\frac{4-3×2+2}{2}$=3,采用sp2杂化,所以CO32-的离子立体结构为为平面三角形,故D正确;
故选D.
点评 本题考查了原子杂化方式的判断和微粒的空间构型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错,题目难度中等.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
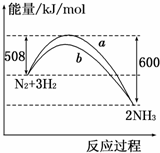
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H4和C4H6 1:1 | B. | CH4和C4H10 5:1 | ||
| C. | C3H4和C3H8 3:1 | D. | C2H2和C4H8 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,在周期表中的位置第四周期ⅢB族,属于d区.
,在周期表中的位置第四周期ⅢB族,属于d区.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | 4mol | C. | 6mol | D. | 3.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 某气体能使品红溶液褪色,该气体一定为SO2 | |
| C. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com