
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
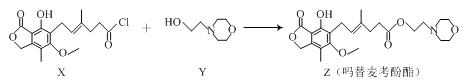 +HCl
+HCl
下列叙述正确的是
A. 用溴水可鉴别化合物X和ZB. 化合物Y的分子式为C6H14NO2
C. 化合物Z中含有手性碳原子D. 1mol化合物Z可以与3mol NaOH反应
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、SO42-、OH-离子中的一种或几种,现通过下实验进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,
③向上述溶液中加入BaCl2溶液,无现象。
据此可以判断该待测液中一定大量存在的离子是_______,一定不能大量存在的离子是_______,不能确定是否存在的离子是___________。
(2)标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,试计算此混合气体中H2的质量为___________,CO体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,据此判断下列说法中不正确的是( )

A.上述反应是置换反应
B.上述反应证明钠可以从CuSO4溶液中置换出铜
C.上述反应说明钠比铜活泼
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中含有下表所示离子中的某5种,且其离子浓度均为![]() (不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子 |
|
阴离子 |
|
A.原溶液中一定含有![]()
B.X溶液中不可能含有![]() 和
和![]()
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
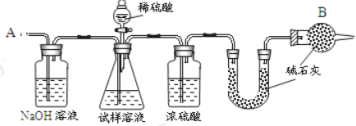
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业综合处理含![]() 废水和含
废水和含![]() 的废气,得无毒气体b,流程如下:
的废气,得无毒气体b,流程如下:
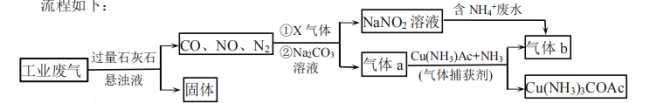
下列说法错误的是( )
A.“固体”中主要含有![]() 、
、![]()
B.X气体、![]() 与
与![]() 溶液的离子反应:
溶液的离子反应:![]()
C.处理含![]() 废水时,离子反应:
废水时,离子反应:![]()
D.捕获剂捕获气体a中![]() 发生了氧化还原反应
发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的O2和O3所含分子的物质的量之比为____________。
(2)等温等压下,等体积的O2和O3所含分子个数比为________________,
(3)在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是________,氧化产物是________,氧化产物与还原产物的物质的量之比为________,被氧化与未被氧化的HCl的质量之比为________,若有73 g HCl被氧化,电子转移的总数为________。
(4)配制100 mL 1 mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是( )
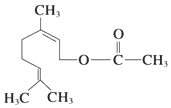
①在Ni催化条件下,1mol该有机物最多可与3mol H2发生加成反应
②该有机物能发生取代、加成、水解、缩聚反应
③该有机物分子式为C12H20O2
④该有机物的同分异构体可能为醇类,不可能为酚类
⑤1mol该有机物水解时只能消耗1mol NaOH
A. ②③④B. ③④⑤C. ②③⑤D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com